汽车安全气囊 是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。
是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。 单质乙就在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
单质乙就在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
| A.KCl | B. KNO3 KNO3 |
C.Na2S | D.CuO |
已知H2O(g) = H2(g) + 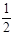 O2(g),反应过程中能量变化如图所示。请回答下列问题:
O2(g),反应过程中能量变化如图所示。请回答下列问题: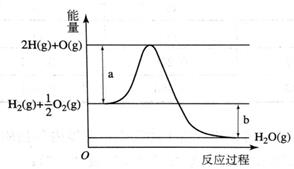
(1)图中a表示___________;
(2)该反应ΔH ______0(填“<”或“>”)。
(1)H2S溶于水的电离方程式为___________________________________________。
(2)①向H2S溶液中加入CuSO4溶液时,电离平衡向_________(填“正向”或“逆向”,下同)移动,c(H+)_______(填“增大”“减小”或“不变”,下同),c(S2-)________;
②向H2S溶液中加入NaOH固体时电离平衡向_________移动,c(H+)_______,c(S2-)________;
下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥氯化钠晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O
其中能够导电的是______________________;(填序号,下同)
强电解质是____________________________;
弱电解质是____________________________;
非电解质是____________________________。
298K时,合成氨反应的反应热△H=-92.4 kJ·mol-1。在该温度下,取1mol N2和3molH2放在一个密闭的容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_______________。
写出下列反应的热化学方程式。
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量_______________________________
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ___________________________