向含0.2molAl3+的明矾溶液中逐渐加入2mol/LBa(OH)2溶液时,测得产生沉淀质量m(g)和逐渐加的2mol/LBa(OH)2溶液的体积(mL)的关系如下图,试填写空白
(1)写出OA段反应的离子方程式
OA ;
(2)m1 = V1 =
m2 = V2=
某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀盐酸;
(4)将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
(5)将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中①肯定含有_______,②不能确定是否含有 _________,③一定不含有_______。
实验室用固体烧碱配制0.1 mol /L的NaOH溶液500 mL,回答下列问题:
(1)计算需要NaOH固体的质量g。
(2)有以下仪器和用品:①烧杯②药匙③250 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平。配制时,必须使用的仪器或用品有(填序号),还缺少的仪器是。
(3)使用容量瓶前必须进行的第一步操作是。
(4)配制时,一般分为以下几个步骤:① 称量② 计算③ 溶解④ 摇匀⑤ 转移⑥ 洗涤⑦ 定容,
其正确的操作顺序为。
(5)配制过程中,下列操作会引起结果偏高的是(填序号)。
① 未洗涤烧杯、玻璃棒② NaOH溶液未冷却至室温就转移到容量瓶并定容
③ 容量瓶不干燥,含有少量蒸馏水④ 称量NaOH的时间太长⑤ 定容时俯视刻度
药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下:
A能使三氯化铁溶液显色。
完成下列填空:
(1)写出A的结构简式:_____________;CH3I的作用___________________。
(2)反应④的化学方程式____________________________________。
H的一种同分异构体的一氯代物的结构为 ,该物质在NaOH水溶液中加热反应时的化学方程式为 。
,该物质在NaOH水溶液中加热反应时的化学方程式为 。
(3)试写出能同时满足以下条件H所有的同分异构体 。
a.能与氯化铁溶液发生显色反应 b.能与碳酸氢钠反应产生无色气泡
c.取0.1mol有机物能与足量Na反应能产生3.36L(标况下)气体
d.苯环上的一氯代物只有两种,但苯环上氢原子数不少3
e.分子中含有甲基
(4)试利用CH3CH=CH2为原料制备 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图例如下: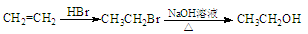
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+__________。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2===S4O
+I2===S4O +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
已知A的分子式为C3H4O2,下图是A~H间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物。(提示:羟基与双键碳原子相连的醇不存在;同一个碳原子上连有2个或多个羟基的多元醇不存在)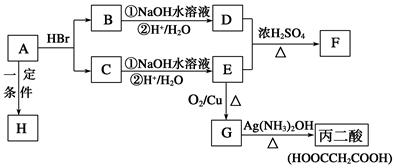
请填写下列空白:
(1)A中含有的官能团有(写名称)__________________。
(2)请写出下列有机物的结构简式:C_______________;F______________
(3)请指出下列反应的反应类型:A→B____________;C→E___________。
(4)请写出下列反应的化学方程式:
①A→H_________________________________________________________;
②B→D(第①步)_______________________________________________。