研究发现,空气其中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用没有相似之处的是( )
| A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 | B.硫化氢通入浓H2SO4中 |
| C.浓H2SO4、铜混合共热 | D.加入少量H2SO4使乙酸乙酯水解 |
如图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )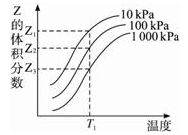
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气体 |
| C.X和Y中只有一种为气态,Z为气态 |
| D.上述反应的逆反应ΔH>0 |
有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如下图所示是A的转化率同压强、温度的关系,分析图象可以得出的正确结论是( )
pC(g)+qD(g),如下图所示是A的转化率同压强、温度的关系,分析图象可以得出的正确结论是( )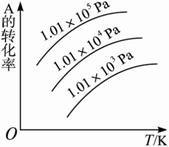
| A.正反应吸热,m+n>p+q |
| B.正反应吸热,m+n<p+q |
| C.正反应放热,m+n>p+q |
| D.正反应放热,m+n<p+q |
在一个活塞式的反应容器中,通入2molSO2和1molO2,于500℃下发生化合反应并达到平衡,在保持恒温、恒压的条件下,再通入2molSO2和1molO2,第二次刚通入后反应速率的变化及最终SO3的含量的有关叙述正确的是
| A.V正增大,V逆减小,SO3的百分含量增加 |
| B.V正增大,V逆不变,SO3的百分含量不变 |
| C.V正增大,V逆增大,SO3的百分含量无法判断 |
| D.V正增大,V逆减小,SO3的百分含量保持不变 |
反应NH4HS(s) NH3(g)+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是()
NH3(g)+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是()
| A.温度、容积不变时,通入SO2气体 | B.移走一部分NH4HS固体 |
| C.容积不变,充入氮气 | D.充入氮气,保持压强不变 |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:
A(s)+2B(g)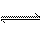 C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |