盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L C.20.16L D.6.72L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 ,反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。
(2) 有下列三个反应:
①Cl2+FeI2=FeCl2+I2;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为_________;
②1molCo2O3能氧化HCl的物质的量_____________。
(3) 完成并配平下列化学反应方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H+ +Zn=Zn2++H2↑,可拆写为氧化反应式:Zn-2e-=Zn 2+,还原反应式:2H++ 2e-=H2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
①将2Fe3++Cu= 2Fe2+ +Cu2+拆写为两个“半反应式”:其中,氧化反应式为。
②由①中的反应,可设计成如右图所示的原电池:
若电极a为Cu ,电解质溶液甲的化学式为;
电极b处的电极反应式为。
化学反应在工农业生产中有着重要的应用。按要求回答下列问题:
(1)利用化学反应可以制备许多物质。
①实验室用铜制备NO的离子方程式为___________________。
②可用Al和Fe2O3制Fe,该反应的化学方程式为___________________。
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-。这两步反应的离子方程式分别为__________、___________。
(2)化学反应能为人类生产生活提供能源。
①由反应CH4 +2O2 CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
②2011年山东高考化学中曾提到钠硫高能电池,右图是该电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx。该电池负极为________(填化学式),正极的电极反应式为 。用该电池作电源进行粗铜精炼时,当得到64g精铜时,理论上该电池负极消耗的质量为_____g。
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
(1)下列说法正确的是(填字母).
| A.元素电负性由大到小的顺序为F>O>N |
| B.一个苯分子含3个π键和6个σ键 |
| C.氯化钠和氯化铯晶体中氯离子的配位数相同 |
| D.第一电离能的大小为Br>Se>As |
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为.光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为(用文字描述).
(3)Cu 2+基态的电子排布式为.向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为,不考虑空间构型,其内界结构可用示意图表示为.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。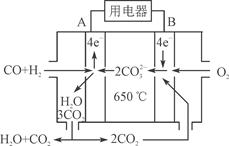
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: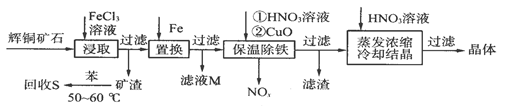
⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。