某冶金厂废水的pH为4.5,含超标10倍的Pb2+。该厂处理废水的下列设计中,比较合理的是 ( )
| A.用离子交换法除去Pb2+ |
| B.在废水中加硫酸,生成PbS04沉淀 |
| C.在废水中加石灰,调节pH到11.0,使Pb2+转化为氢氧化物沉淀 |
| D.在废水中加NaOH,调节pH到11.0,使Pb2+转化为氢氧化物沉淀 |
下列离子方程式与所述事实相符且正确的是:
| A.漂白粉溶液通入少量SO2:2ClO-+SO2+Ca2++H2O=2HClO+CaSO3↓ |
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-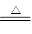 Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解可生成白色难溶物,阳极的电极反应式为:Al - 3e--+3HCO3-=Al(OH)3↓+3CO2↑ |
| D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法错误的是
| A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ |
| B.根据反应①和②推知反应: H2(g)+1/2O2(g)=H2O(g)的△H=-241.9kJ/mol |
| C.CH3OH转变成H2的过程不一定要吸收能量 |
| D.反应①中的能量变化如图所示 |

以下实验或操作不能达到目的的是
| A.用溴水鉴别苯、乙醇、四氯化碳三种无色液体 |
| B.为除去甲烷气体中的少量乙烯,可将气体通入KMnO4溶液中 |
| C.为除去乙酸乙酯中的少量乙酸,可向混合物中加入适量的饱和碳酸钠溶液后分液 |
| D.用激光笔检验淀粉溶液的丁达尔现象 |
下列说法错误的是
| A.还原性:Fe2+>I—>Br—>Cl— |
| B.氧化性:Fe3+ > Cu2+ >Zn2+ |
| C.酸性:H2SO4>CH3COOH> H2CO3>HClO |
| D.常温下跟钠反应的剧烈程度: 乙酸> 水>乙醇 |
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。X、Y也是短周期主族元素,且X+、Y2-的核外电子排布相同。下列说法错误的是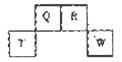
| A.非金属性:Q <W |
| B.Q、R、W三种元素的常见单质中所含微粒间的作用力完全相同 |
| C.原子半径:X>T;离子半径:X+<Y2- |
| D.T单质能与X的最高价氧化物的水化物反应 |