目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们的燃烧反应如下: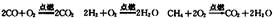
根据以上化学方程式判断,燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是(1)____________,因此燃烧管道煤气的灶具如许改烧天然气,灶具的改进方法是(2)_____进风口(填“增大”或“减小”),如不改进可能产生的不良后果是(3)_____________________________________________________。
管道煤气中含有的烃类,除甲烷外还有少量乙烷、丙烷、丁烷等他们的某些性质见下表:
| |
乙烷 |
丙烷 |
丁烷 |
| 熔点/℃ |
-183.3 |
-189.7 |
-138.4 |
| 沸点/℃ |
-88.6 |
-42.1 |
-0.5 |
试根据以上某个关键数据解释冬天严寒季节有时管道煤气火焰很小,并且呈断续状态的原因是_______________________________________________________________
(1)CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体的平均摩尔质量为,CH4与CO2的分子个数比为。对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(2)现有下列6种物质:CO2、SiO2、CaO、MgO、Fe2O3、C。
按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________________②________________________________________。
(3)从上述物质中分别找出两种能相互反应的物质, 各写一个非氧化还原
各写一个非氧化还原 反应的方程式和氧化还原反应的方程式:________________________________,____________________________________
反应的方程式和氧化还原反应的方程式:________________________________,____________________________________
(4)生活中的食醋和淀粉溶液分别属于分散系中的_____和______,用___________可以鉴别(填化学专用名词)。
(12分,每空2分)(Ⅰ)一个体重50 kg的健康人含铁元 素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
⑴人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+。在
Fe3+。在 过程A中,Fe2+作剂,过程B中,Fe3+作剂。
过程A中,Fe2+作剂,过程B中,Fe3+作剂。
⑵“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作剂,具有性。
(Ⅱ)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为 ;
;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为;
(10分,每空2分)(1)下列反应中属于氧化还原反应的是。(填序号)
| A.MnO2 + 4HCl(浓)= MnCl2 + Cl2↑+ 2H2O | B.SO2+2H2S = 2H2O+3S↓ |
C.Ba(OH)2 + H2S O4 = BaSO4↓+2H2O O4 = BaSO4↓+2H2O |
D.Cl2+2NaOH =" NaCl" +NaClO+H2O |
(2)已知KMnO 4与浓盐酸发生如下反应:
4与浓盐酸发生如下反应:
2KMnO4 + 16HCl(浓) ="==" 2KCl + 2MnCl2 + 5Cl2↑+8H2O。
在上述反应中,氧化剂是。用单线桥法标出此反应的电子转移方向和数目。
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
________+________+H2SO4→ ________+________+________(填化学式)
②反应中1mol氧化剂得到______mol电子。
(12分,每空2分)(Ⅰ)写出下列物质在水溶液中的电离方程式:
NaHSO4,K2SO4,
NH4NO3 , Al2(SO4)3 ___________________________________。
(Ⅱ)将下列离子反应,改写成对应的化学方程式:
(1)Cu + 2Ag+ = Cu2++ 2Ag;___________________________________
(2) CaCO3 + 2H+ = CO2↑+ H2O +Ca2+;_______________ ________________
________________
某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
| 实验编号 |
 T/K T/K |
KMnO4浓度 /mol·L-1 |
H2C2O4浓度 /mol·L-1 |
实验目的 |
| ① |
298 |
0.01 mol·L-1 |
0.1 mol·L-1 |
为以下实验做对照 |
| ② |
||||
| ③ |
探究浓度对反应速率的影响 |
(2)实验记录:实验中需要记录的数据是。