用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B.标准状况下,22.4L己烷中共价键数目为19NA |
| C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
下列有关化学用语能确定为丙烯的是
A.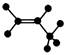 |
B.C3H6 | C. |
D.CH2=CH-CH3 |
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
下列有关说法正确的是
| A.该反应的正反应是气体体积减小的吸热反应 |
| B.K1<K2(K为该条件下反应的平衡常数) |
| C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动 |
| D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压 |
下图为室温下0.2 mol/L CH3COOH溶液逐滴滴加到25.00 mL 0.1mol/L NaOH溶液中pH的变化曲线,下列说法正确的是:
| A.若选用甲基橙指示CH3COOH滴定未知浓度的NaOH溶液的滴定终点,则测定结果偏低 |
| B.反应过程中溶液中阴、阳离子总数目:b 点大于c点 |
| C.因为CH3COONa溶液显碱性,所以当向CH3COOH溶液中加入CH3COONa时,CH3COOH电离程度将增大 |
| D.a、c区间内,c(Na+)一定大于c(CH3COO-),但c(OH-)可能大于、小于或等于c(CH3COO-) |
某温度下,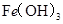
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液 ,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
A.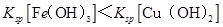 |
B.加适量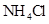 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C. 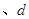 两点代表的溶液中 两点代表的溶液中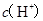 与 与 乘积相等 乘积相等 |
D. 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |
将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
| A.0.3mol NO2和0.3mol NO | B.0.2mol NO2和0.1mol N2O4 |
| C.0.1mol NO、0.2mol NO2和0.05mol N2O4 | D.0.6mol NO |