有一未完成的离子方程式为:□□+XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为()
| A.+7 | B.+4 | C.+5 | D.+1 |
雌二醇和睾丸素均属类固醇类化合物,该类化合物的结构特征是含有相同的“三室一厅”(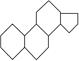 )的核心构架。这两种化合物的结构简式如下:
)的核心构架。这两种化合物的结构简式如下:
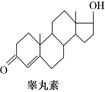
下列关于雌二醇和睾丸素的叙述中,不正确的是()
| A.均能与卤化氢发生取代反应 |
| B.均能发生消去反应 |
| C.均可使溴水褪色 |
| D.两种物质的分子组成相差一个CH2,属于同系物 |
已知(CH3)2C=CH2,可表示为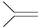 ,脱落酸(如图)可用作植物生长抑制剂,下列对该物质的叙述正确的是()
,脱落酸(如图)可用作植物生长抑制剂,下列对该物质的叙述正确的是()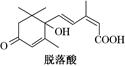
| A.其分子式为C15H22O4 |
| B.其属于芳香族化合物 |
| C.1 mol该物质最多可与3 mol H2发生反应 |
| D.该物质在一定条件下可发生自身取代反应生成含七元环的物质 |
青霉素是一种良效广谱抗生素,经酸性水解后得到青霉素氨基酸分子的结构简式如图。下列关于该物质的叙述不正确的是()
| A.属于α氨基酸 |
| B.能发生加聚反应生成多肽 |
| C.该物质共有五种不同环境的氢原子 |
| D.青霉素过敏严重者会导致死亡,用药前一定要进行皮肤敏感试验 |
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为()
| 1 |
2 |
3 |
4 |
5 |
6 |
…… |
| …… |
C2H6 |
C5H12 |
C8H18 |
…… |
…… |
A.C14H30B.C17H36 C.C20H42D.C26H54
根据下表中烃的分子式排列规律,判断空格中烃的分子式是()
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| CH4 |
C2H4 |
C3H4 |
C4H10 |
C5H10 |
C6H10 |
C7H16 |
A.C7H18B.C8H16 C.C8H18D.C7H14