氧化还原反应实际上包含氧化和还原两个过程:①向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O – 2e-→ SO42-+ 4H+;②向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-,在①和②反应中均会生成产物X,则X的化学式为 ( )
| A.NaClO | B.HClO | C.ClO2 | D.NaClO4 |
下列关于氯水的叙述正确的是
| A.新制氯水中只含Cl2和H2O分子 |
| B.新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C.光照氯水有气泡放出,该气体主要是Cl2 |
| D.氯水放置数天后pH值将变大 |
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl﹣物质的量浓度相同的是
| A.100mL 0.25mol/L MgCl2溶液 | B.200mL 0.25mol/L AlCl3溶液 |
| C.50mL 1mol/L NaCl溶液 | D.25mL 0.5mol/L KClO3溶液 |
下列仪器的使用、记录的数据或实验的结论正确的是
| A.用25mL量筒量取22.30mL盐酸 |
| B.用托盘天平称量8.75g食盐 |
| C.将20gNa2CO3溶于80g水中制得20%的Na2CO3溶液 |
| D.将标准状况下22.4LHCl气体溶于1L水中可制得1mol/L盐酸 |
下列实验操作中,不能用于物质分离的是
A. |
B.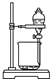 |
C. |
D. |
体积为V(mL)、密度为ρ(g·cm-3)的溶液,含有摩尔质量为M的溶质质量为m(g),物质的量浓度为c,质量分数为w。下列表达式中不正确的是
A.c=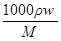 |
B.m=V·ρ·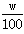 |
C.w=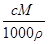 |
D.c=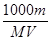 |