现有A.B.C三种化合物,各取40g相混合,完全反应后,得B18g,C49g,还有D生成。已知D的式量为106。现将22gA和11gB反应,能生成D ( )
A.1mol B.0.5mol C.0.275mol D.0.25mol
在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是()
①过滤②加过量的NaOH溶液③加适量的盐酸
④加过量的碳酸钠溶液⑤加过量的氯化钡溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤④②③① |
中学化学教材中有大量数据,下列是某同学对数据利用情况,正确的是()
| A.利用焓变的数据或熵变的数据一定都能单独判断反应是否能自发进行 |
| B.利用反应热数据的大小判断不同反应的反应速率的大小 |
| C.利用沸点数据推测将一些液体混合物分离开来的可能性 |
| D.利用溶液的pH与7的大小关系,判断PH=6.8的溶液一定显酸性 |
下列说法正确的是()
| A.摩尔是一种国际基本物理量 |
| B.标准状况下1摩尔SO3的体积约为22.4 L |
| C.常温常压下,11.2 LN2含有的分子数为0.5NA |
| D.在同温同压下,相同体积的任何气体单质所含分子数相同 |
标准状况下,112 mL某气体的质量是0.17 g,该气体可能是()
| A.O2 | B.N2 | C.H2S | D.CO2 |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
A. |
B. |
C.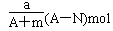 |
D.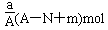 |