下列各组物质的溶液混合后,再加足量的稀硝酸,仍有沉淀存在的是( )
| A.K2CO3、CaCl2 | B.AgNO3、HCl |
| C.NaOH、CuSO4 | D.Na2CO3、BaCl2 |
下列事实不能用勒夏特列原理解释的是( )
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
C.向氯水中加CaCO3后, 溶液漂白性增强 溶液漂白性增强 |
| D.在硫化氢水溶液中加入碱有利于S2- |
下列电离方程式书写正确的是( )
| A.NaHSO4=Na++H++SO (熔融态) | B.NaHCO3=Na++H++CO |
C.CH3COOH CH3COO-+H+ CH3COO-+H+ |
D.H2CO3 2H++CO 2H++CO |
下列说法正确的是 ( )
| A.放热反应一定是自发进行的反应 |
| B.化学反应的熵变与反应的方向无关 |
| C.焓变小于0而熵变大于0的反应肯定是自发的 |
| D.只有不需要任何条件就能够自动进行的过程才是自发过程 |
把0.05 mol NaOH固体,分别加入下列100  mL溶液中,溶液的导电能力变化不大的是( )
mL溶液中,溶液的导电能力变化不大的是( )
①自来水②0.5 mol·L-1盐酸 ③0.5 m ol·L-1醋酸 ④0.5 mol·L-1 NH4Cl溶液
ol·L-1醋酸 ④0.5 mol·L-1 NH4Cl溶液
| A.①② | B.②④ | C.③④ |
D.②③ |
下列图象能正确地表达可逆反应3A(g)+B(g)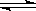 2C(g)(△H<0)的是( )
2C(g)(△H<0)的是( )