
| A.横坐标从5到6溶液中Al3+浓度在上升 |
| B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl—)=1∶1∶5 |
| C.A是NaOH,B是盐酸,且c(NaOH)∶c(HCl)=2∶1 |
| D.横坐标从6到9,相应离子反应式H++OH— =H2O |
下列条件一定能使反应速率加快的是( )。
①增加反应物的物质的量 ②升高温度 ③增大反应体系的压强 ④不断分离出生成物 ⑤加入MnO2
| A.全部 | B.①②⑤ | C.② | D.②③ |
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )。
A.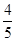 v(NH3)=v(O2) v(NH3)=v(O2) |
B.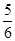 v(O2)=v(H2O) v(O2)=v(H2O) |
C. v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.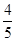 v(O2)=v(NO) v(O2)=v(NO) |
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |
有关热化学方程式书写与对应表述均正确的是( )。
| A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1 |
| C.氢气的燃烧热为285.5 kJ·mol-1,则水电解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1 |
| D.已知2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·mol-1 |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是( )。
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |