某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:

|




|
有关的离子反应方程式为
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。| 实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
| ① |
30 |
5 |
0 |
85 |
2 |
3.8 |
| ② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
| ③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
| ④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
| ⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验 和 证明物质D的用量越大,反应速率越快。
(6)写出步骤①中发生反应的化学方程式 ,____________________
重金属盐可使人中毒。当人误食重金属盐时,可以喝解毒。原因是上述食品中含有较多的,可以跟重金属盐形成不溶于水的化合物,可以减轻重金属盐类对胃肠黏膜的危害,起到缓解毒性的作用。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: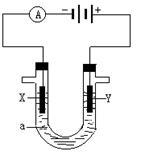
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X 极上的电极反应为____________,在X极附近观察到的现象是:____________。
(2)Y电极上的电极反应式是_________,检验该电极反应产物的方法是:________________。
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,电极反应式是__________________,Y电极的材料是_________,电极反应式是__________________。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O请回答下列问题
2PbSO4+2H2O请回答下列问题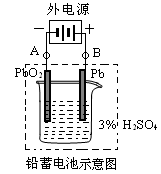
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量减少________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,此时铅蓄电池的正负极的极性与原来______。(“相同”或“不同”)(每空2分)
已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验,向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的__________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”减小”或“不变”)。(已知:25 ℃时,NH3·H2O的Ka=1.8×10-5,CH3COOH的Kb=1.8×10-5)
(1)将等质量的Zn粉分别投入:试管A: 10mL 0.1mol·L-1 HCl和试管B: 10mL 0.1mol·L-1醋酸中: 开始时,反应速率AB(填>,=或<,下同),若Zn过量,产生H2的体积AB。
(2)将等质量Zn粉分别投入pH=1体积均为10mL的试管A: 盐酸和试管B: 醋酸中: 开始时,反应速率AB(填>,=或<,下同),若Zn过量,产生H2的体积AB。