请在横线部分写出正确的化学方程式或离子方程式(每题2分,共12分)
(1)镁在二氧化碳中燃烧 。
(2)铝与碱溶液反应的离子方程式 。
(3)实验室制氢氧化铝的离子方程式 。
(4)铝与四氧化三铁高温反应 。
(5)氢氧化亚铁在空气中变质 。
(6)少量铁在氯气中燃烧  。
。
某无色废水中可能含有
H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:Ⅰ:
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有__________;
(2)实验③中所发生反应的离子反应方程式__________;
(3)分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为, NO3-是否存在?__________填(“存在”“不存在”或“不确定”)。
Ⅱ:现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)A溶液呈碱性的原因是__________________(用离子方程式表示);
(2)D是______________溶液,E是______________溶液(均写化学式)。
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol・L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g・L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
[化学选修3—物质结构与性质]开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个;
②LiBH4由Li+和BH4-构成,BH4-的等电子体是(写一种).LiBH4中不存在的作用力有____(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 |
I2/KJ•mol-1 |
I3/KJ•mol-1 |
I4/KJ•mol-1 |
I5/KJ•mol-1 |
| 738 |
1451 |
7733 |
10540 |
13630 |
M是______(填元素符号).
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有______种;
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HF_______________________;
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X-定不是________(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为_____。
A.87.5% B.92.9% C.96.3% D.100%
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量不减少,请回答下列问题: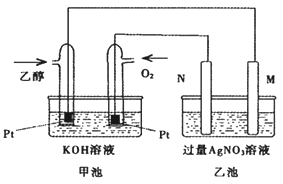
(1)M电极的组成元素在周期表中的位置是_________________,电极名称是__________,加入乙醇的铂电极的电极反应式为________________,写出乙池中发生的化学反应的离子式________________;
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为____________L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为________;
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为________________;
(4)甲烷也是一种很好的清洁能源.蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol.356g“可燃冰”(若分子式为CH4•9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为__________kJ;
海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
(一)某化学研究小组用右图装置模拟步骤I电解食盐水(用铁和石墨做电极)。
(1)a电极材料是 (填铁、石墨),其电极反应式为 。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为 (忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氢氧化物沉淀的pH:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
8.1 |
3.8 |
9.5 |
| 完全沉淀pH |
3.7 |
9.6 |
4.8 |
11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是______________(填序号,下同),加入
调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是: 。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是 。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式: 。