下列溶液中n(CI-) 与50mL 1mol/L 氯化铝溶液中的n(CI-) 相等的是:
| A.150 mL 1mol/L 氯化钠溶液 | B.75 mL 2mol/L 氯化镁溶液 |
| C.150 mL 2mol/L氯化铵溶液 | D.50 mL 3mol/L 氯化铁溶液 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+ H2O(l) ="=" Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—="=" Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
结合下图判断,下列叙述正确的是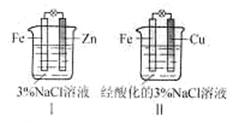
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
根据下图,下列判断中正确的是
| A.烧杯a中的溶液pH降低 |
| B.烧杯b中发生氧化反应 |
| C.烧杯a中发生的反应为2H++2e-===H2 |
| D.烧杯b中发生的反应为2Cl--2e-===Cl2 |
将Al片和Cu片用导线相连,一组插入稀H2SO4溶液中,一组插入浓NaOH溶液中,分别形成了原电池。则在这两个原电池中
| A.Al片均作阴极 |
| B.电解质溶液的pH均逐渐升高 |
| C.Cu片上均有气泡放出 |
| D.电路中流过等物质的量的电子时,放出等体积的气体 |
下列叙述错误的是
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.铁管上镶嵌锌块,铁管不易被腐蚀 |