往100mL pH=0的硫酸 和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为( )
和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为( )
| A.0.02mol | B.0.08ml | C.0.10mol | D.0.16mol |
下列离子方程式错误的是()
| A.硫化钠溶液中加生产方式足量盐酸:S2—+2H+→H2S↑ |
| B.向碳酸氢钙溶液中开始滴入氢氧化钠溶液: Ca2++2HCO3—+2OH—→CaCO3↓+2H2O+CO32— |
| C.用硫酸铜溶液吸收硫化氢气体:Cu2++H2S→CuS↓+2H+ |
| D.向浓氨水中开始滴入硫酸铝溶液:A13++3NH3+H2O→A1(OH)3↓+3NH4+ |
有机反应中会出现CH3+、(CH3)2CH+等中间体,(CH3)2CH+在氢氧化钠溶液中反应可得到的有机物的结构简式是()
| A.C3H8O | B.C2H6O | C.CH3—CH(OH)—CH3 | D.CH2CH3CH2—OH |
有关能量的判断或表示方法正确的是()
| A.由:H++OH—→H2O+57.3KJ,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放热量大于57.5KJ |
| B.从C(石墨)→C(金刚石)-119KJ,可知:金刚石比石墨更稳定 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| D.2gH2完全燃烧生成液态水放出285.8KJ热量,则氢气燃烧的热化学方程式为: |
2H2(g)+O2(g)→2H2O(1)+285.8KJ
下列实验能达到预期目的的是( )
| 编号 |
实验内容 |
实验目的 |
||
|
由部分短周期元素形成的单质或氧化物之间有以下关系
单质X + 氧化物M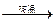 氧化物N
氧化物N
单质Y + 氧化物M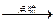 单质X + 氧化物R
单质X + 氧化物R
单质X + 氧化物Z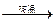 单质D + 氧化物N
单质D + 氧化物N
若X为非金属单质,则组成Y单质的元素在周期表的位置是
| A.第二周期ⅣA族 | B.第二周期ⅥA族 |
| C.第三周期ⅡA族 | D.第三周期ⅣA族 |