A、B、C、D、E、F、G是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示: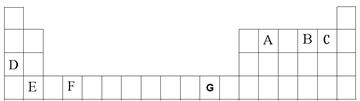
⑴写出G的基态原子核外电子排布式:__________________。
⑵B元素氢化物接近沸点的蒸气的相对分子质量测定值比用化学式计算 出来的相对分子质量大一些,其原因是:。
出来的相对分子质量大一些,其原因是:。
⑶EB晶胞如右图所示,EB晶体中E2+的配位数为 ,EB晶体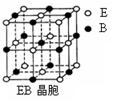
和NaCl晶体中离子排列方式相同,其晶格能分别为:
EB-3401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要
原因是_______________________________________________。
⑷请用原子结构的知识解释检验D元素时焰色反应产生的现象的原因是
某待测液中(所含阳离子为Na+) 可能含有SO42-、SO32-、Cl-、Br-、
|
NO3-、CO32-、HCO3-中的一种或几种,进行下列实验(每次实验所加试剂均足量)。回答以下问题:
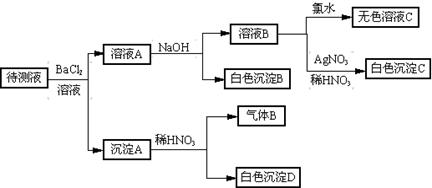
 。
。
下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一。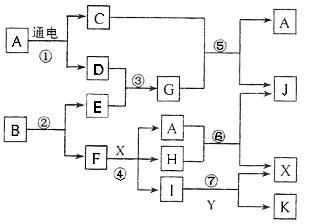
 请按要求填空:(1)写出A的电子式、F元素在周期表位置(2)反应⑤的化学方程式为:。
请按要求填空:(1)写出A的电子式、F元素在周期表位置(2)反应⑤的化学方程式为:。
(3)常温下,G和X反应生成Z,写出0.1mol/L Z溶液中离子浓度由大到小的顺序是。
(4)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为。
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知2SO2(g)+ O2(g)  2SO3(g)
2SO3(g) 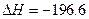 kJ·mol
kJ·mol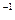 )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2mol SO2、1mol O2 |
2mol SO3 |
4mol SO3 |
SO3的浓度(mol· L L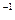 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
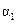 |
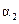 |
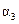 |
(1)根据上表下列说法正确的是
A.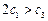 B.
B.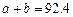 C.
C.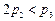 D.
D.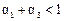
(2)甲容器中的进行反应的平衡常数表达式。
(3)甲容器平衡时SO2的转化率(用含有a的代数式表示)
(4)关于2SO2(g)+ O2(g)  2SO3(g)下列说法正确的是
2SO3(g)下列说法正确的是
A.保持容器等温等压状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
B.平衡时,测得 SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
C.反应混合物中,SO3的质量分数不再改变时反应处于平衡
D.保持容器等温等容状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
(1)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下 :
: aA (g)+ bB (g)
aA (g)+ bB (g)  2C(g)
2C(g)  起始物质的量(mol): 320
起始物质的量(mol): 320
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a=,b=;
②2S内B的反应速率=。
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:
③有个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为(不考虑溶液体积变化)。
(3)将2.3g金属钠放入足量的mg重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是(用含m的代数式表示)。