根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g ) △H = -297.23 kJ/mol (反应在298K,101kPa下发生)分析下列说法不正确的是( )
| A.标况下,燃烧1mol S放出的热量为297.23 kJ |
| B.S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量大于297.23 kJ |
| C.S ( g ) + O2 ( g ) = SO2 ( g )放出的热量小于297.23 kJ |
| D.形成1 mol SO2的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
对羟基苯乙酮是一种利胆有效成分,它是从中草药茵陈蒿中提取的,其结构简式为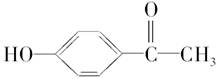 ,
,
这是一种值得进一步研究的药物。推测该药物不具有的化学性质是( )
| A.能跟氢氧化钾反应 |
| B.能跟浓溴水反应 |
| C.能跟碳酸氢钠反应 |
| D.在催化剂存在时能被还原成含醇羟基的物质 |
在防止禽流感疫情时,防疫部门使用了大量含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4~5倍。下列有关氯胺(NH2Cl)的说法一定不正确的是( )
| A.氯胺的水解产物为NH2OH(羟胺)和HCl |
| B.氯胺一定条件下可与乙烯加成得H2NCH2CH2Cl |
| C.氯胺的消毒原理与漂白粉相似 |
D.氯胺的电子式为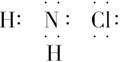 |
土壤污染物主要来自( )
①工业三废 ②动植物遗体 ③生活垃圾 ④污染的大气 ⑤农药和化肥 ⑥枯枝落叶
| A.①②⑤⑥ |
| B.①④⑤ |
| C.①③⑤ |
| D.②⑤ |
下列说法正确的是( )
| A.物质是不灭的,因此人类可以无限制开发和利用地球上的资源 |
| B.化学工业是污染的罪魁祸首,因此应当限制化学的发展 |
| C.化肥可以快速地提高农作物的产量,因此我们应当大力提倡使用 |
| D.吸烟有害健康,是因为吸烟会产生多种有害的化学物质进入人体 |
下列关于生产、生活中的化学问题的叙述,正确的是( )
| A.在使用或生产易燃、易爆物的工厂车间,最好不穿化纤类工作服 |
| B.糯米中的淀粉一经水解就能酿造成酒 |
| C.食用植物油的主要成分是高级饱和脂肪酸的甘油酯,是人体内不可缺少的重要营养物质 |
| D.市场销售的洗涤灵的主要成分是对十二烷基苯磺酸钠,它能洗去餐具上的油污,主要发生化学变化 |