下列变化为放热反应的是( )
| A.H2O(g) ==H2O(l) ΔH="=-44.0" kJ·mol-1 |
| B.2HI(g) ==H2(g)+I2(g) ΔH==+14.9kJ·mol-1 |
| C.形成化学键时共放出能量862 kJ的化学反应 |
| D.能量变化如右图所示的化学反应 |
在容积一定的密闭容器中,反应A(g)+2B(g) 2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是
2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是
A.1 <X/Y<3 B.3< X/Y <4
C.0.25< X/Y <1.5D.0.25< X/Y <0.5
下图是向25.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH变化的图象,根据图象分析,下列结论中不正确的是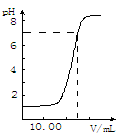
| A.盐酸起始浓度为0.10 mol·L-1 |
| B.NaOH溶液浓度为0.10 mol·L-1 |
| C.滴到中点时,耗NaOH物质的量为0.0025mol |
| D.滴入碱量为20.00mL时,向混合溶液中滴入2滴酚酞试液,溶液显红色 |
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是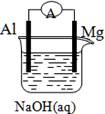
| A.Mg比Al活泼,Mg 失去电子被氧化成Mg2+ |
| B.负极反应式为:Al+4OH--3e-=AlO2-+2H2O |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
0.1 mol/L和0.2mol/L。下列判断正确的是
| A.25℃时,该反应的平衡常数K=0.2 |
| B.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| C.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大 |
| D.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
在容积一定的密闭容器中,发生可逆反应:A(g) + B(g)  xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是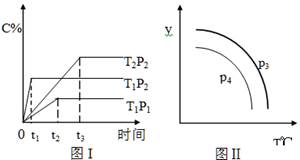
| A.x=2,T1>T2,P2>P1 |
| B.P3>P4,y轴表示B的质量分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |