工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)="===Si(s)+4HCl(g)" ΔH=" +Q" kJ·mol-1 (Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应 |
25℃,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是()
A.CH3COOH(aq)+NaOH(aq)="==" CH3COONa(aq)+H2O(l) 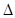 H= H=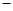 57.3kJ/mol 57.3kJ/mol |
B.KOH(aq)+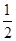 H H SO4(aq)= SO4(aq)= 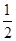 K2SO4(aq)+H2O(l) K2SO4(aq)+H2O(l)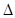 H= H=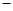 57.3kJ/mol 57.3kJ/mol |
C.C8H18(l)+ 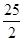 O2 (g)=8CO2 (g)+ 9H2O(g) O2 (g)=8CO2 (g)+ 9H2O(g)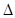 H= H=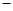 5518 kJ/mol 5518 kJ/mol |
D.2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)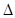 H= H=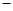 11036 kJ/mol 11036 kJ/mol |
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1)△H1 = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2 = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H3 = ―Q 3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是()
| A.放出的热量为(0.4Q1+0.05Q3)KJ/mol |
| B.放出的热量为(0.4Q1+0.05Q2)KJ/mol |
| C.△H2>△H3 |
| D.△H2<△H3 |
已知25℃、101kPa下,石墨、金刚石燃烧热化学方程式分别为
C(石墨)+O2(g)===CO2(g) ΔH=" -393.51kJ·mol-1"
C(金刚石)+O2(g)===CO2(g)ΔH=-395.41kJ·mol-1
据此判断,下列说法中正确的是()
| A.由石墨制备金刚石是吸热反应 |
| B.由石墨制备金刚石是放热反应 |
| C.石墨的能量比金刚石的低 |
| D.石墨的能量比金刚石的高 |
将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
| A.该反应是吸热反应 | B.该反应是放热反应 |
| C.铁粉和硫粉在常温下难以发生反应 | D.硫化亚铁的总能量高于铁粉和硫粉的总能量 |
下列关于反应热的说法正确的是()
| A.当∆H为“-”时,表示该反应为吸热反应 |
B.已知C(s)+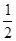 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |