氯化铁溶液和氢氧化铁胶体具有的共同性质是 ( )
| A.分散系颗粒直径都在1~100nm之间 | B.能透过半透膜 |
| C.加热蒸干、灼烧后都有氧化铁生成 | D.呈红褐色 |
某溶液可能含有Cl—、SO42—、CO32—、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确定其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是
| A.原溶液中c(Fe3+)="0.2" mol·L—1 |
| B.原溶液中至少有4种离子存在,其中Cl—一定存在,且c(Cl—)≥0.2 mol·L—1 |
| C.原溶液中SO42—、NH4+、Na+一定存在,CO32—、Al3+一定不存在 |
| D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液呈血红色,则含有Fe2+ |
化合物X、Y、Z之间有如图所示的转化关系。下列说法中不正确的是
| A.图中的每一步反应都是氧化还原反应 |
| B.钠与Y物质的反应属于氧化还原反应,但不是离子反应 |
| C.X与Y的反应中,氧化剂和还原剂都是X |
| D.Z的水溶液能使酚酞试液变红 |
下列说法正确的是
| A.已知CO(g)的燃烧热ΔH=-283.0 kJ·mol-1,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol |
| B.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多。 |
| C.H2(g)+F2(g)=2HF(g);ΔH1="a" kJ/mol;H2(g)+Cl2(g)=2HCl(g);ΔH2="b" kJ/mol ΔH1<ΔH2 |
D.C(s)+H2O(g)  CO(g)+H2(g);ΔH>0,若平衡后再充入一定量水蒸气,则ΔH增大 CO(g)+H2(g);ΔH>0,若平衡后再充入一定量水蒸气,则ΔH增大 |
关于原子轨道的说法正确的是
| A.凡是中心原子采取sp3杂化轨道成键的分子立体构型都是正四面体 |
| B.CH4中的sp3杂化轨道是4个H原子的1s 轨道和C原子的2p轨道混合形成 |
| C.sp3杂化轨道是由同一原子中能量相近的s 和p轨道混合形成的一组新轨道 |
| D.凡AB3型的共价化合物,中心原子A均采用sp3杂化轨道成键 |
向下图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化;若打开活塞K,则品红溶液褪色。X和Y可能是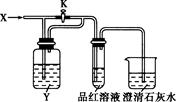
| A |
B |
C |
D |
|
| X |
SO2 |
NO2 |
HCl |
C12 |
| Y |
饱和NaHCO3溶液 |
水 |
Na2SO3溶液 |
Na2SO3溶液 |