已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。
N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。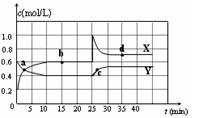 下列说法不正确的是( )
下列说法不正确的是( )
| A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线 |
| B.前10 min内用v(N2O4)表示的化学反应速率为0.02 mol/(L·min) |
| C.25 min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L |
| D.前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L·min) |
化学用语是学习化学重要工具,下列化学用语中,书写不正确的是
A.CH3COOH在水中的电离:CH3COOH CH3COO— + H+ CH3COO— + H+ |
B.碳酸氢钠的水解:HCO3— + H2O  CO32- + H3O+ CO32- + H3O+ |
C.电解硝酸银溶液:4Ag+ + 2H2O  4Ag + 4 H+ + O2↑ 4Ag + 4 H+ + O2↑ |
| D.向含有硫酸钙的水垢中加入碳酸钠溶液,沉淀的转化可表示为: |
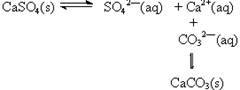
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,负极反应式为:Al - 3eˉ=Al3+ |
| B.由Fe、Cu、FeCl3溶液组成原电池,正极反应式为:2Fe3+ + 2eˉ=2Fe2+ |
| C.由Mg、Al、NaOH溶液组成原电池,负极反应式为:Al - 3eˉ+ 3OHˉ=Al(OH)3 |
| D.由Al、Cu、浓硝酸组成原电池,正极反应式为:4H+ + 2NO3- + 2eˉ=2NO2 + 2H2O |
有两位希腊化学家,把氢气和氮气通入到一加热的电解池中,用多孔钯多晶薄膜催化电解,结果在常压下获得了氨,且转化率远高于通常合成氨工艺的转化率。则下列有关叙述不正确的是
| A.在该装置内,氮气在阴极区发生反应 |
| B.使用高效催化剂可提高合成氨的转化率 |
| C.该过程中有电能转化为化学能 |
| D.合成氨反应是放热的,所以该装置还可以向外界提供能量 |
已知H—H键能为436 kJ/mol,H—N键能为391 kJ/mol,根据热化学方程式:
N2 (g)+ 3H2(g) 2NH3(g)ΔH =" -92.4" kJ/mol,则N≡N键的键能是
2NH3(g)ΔH =" -92.4" kJ/mol,则N≡N键的键能是
| A.431 kJ/mol | B.946 kJ/mol | C.649 kJ/mol | D.869 kJ/mol |
如下图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是
A.2NO2 N2O4是放热反应 N2O4是放热反应 |
B.NH4Cl溶于水时放出热量 |
| C.烧瓶(1)中平衡混合气的相对分子质量增大 | D.烧瓶(3)中气体的压强增大 |