不能用H++OH-=H2O表示的化学反应是 ( )
| A.稀硫酸与氢氧化钡溶液反应 | B.稀盐酸与氢氧化钠溶液反应 |
| C.稀盐酸与氢氧化铜反应 | D.稀硝酸与氢氧化铝反应 |
在容积不变的密闭容器中有反应:X(g) + Y(g) 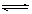 z(g),若Z(g)的物质的量浓度c(Z)
z(g),若Z(g)的物质的量浓度c(Z) 与温度T的关系如右图所示。
与温度T的关系如右图所示。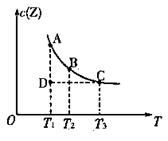
则下列说法不正确的是
A.A点与B点相比,B点的c (X)大
B.A点与C点的化学反应速率:前者<后者
C.在反应进行到D点时,V正<V逆
D.A、B、C点都表示该反应达平衡状态
下列叙述正确的是
A.恒容密闭容器中进行的反应3A(g)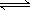 B(g)+C(g),在其它条件不变情况下, B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
| B.对于可逆反应N2(g)+3H2(g)==2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 |
| C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s) △H<0在任何条件下均能自发进行 |
某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有
| A.2种 | B.3种 | C.4种 | D.5种 |
下列说法不正确的是
| A.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物 |
| B.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷 |
| C.外加直流电源,将钢铁设备作为阴极进行保护 |
| D.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如右图所示,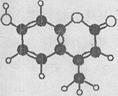
下列有关叙述正确的是
① 能与溴水发生取代反应②1 mol该物质最多能与4 mol H2加成③能使酸性KMn04溶液褪色④1 mol该物质最多能与含2 mol NaOH的溶液反应
A.①②③B.①③④C.③④D.②③④