通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是 ( )
| |
现象 |
解释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
| D |
铜片放入浓硫酸中,无明显变化 |
说明铜在冷的浓硫酸中发生钝化 |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
| A.离子半径:T< W< G |
| B.最简单气态氢化物的热稳定性:Q < R |
| C.最高价氧化物对应水化物的酸性:Q >W>G |
| D.T和G组成的化合物甲溶于水,其水溶液呈中性 |
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.原子半径:Z>Y>X |
| B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 |
| C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂 |
| D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2 |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
| A.原子半径的大小顺序: r(Y)>r(Z)>r(W) |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
| A.16O2与18O2互为同分异构体 |
| B.16O与18O核外电子排布方式不同 |
| C.通过化学变化可以实现16O与18O间的相互转化 |
| D.标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是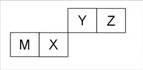
| A.原子半径Z<M |
| B.Y的最离价氧化物对应水化物的酸性比X 的弱 |
| C.X 的最简单气态氢化物的热稳定性比Z的小 |
| D.Z位于元索周期表中第2 周期、第ⅥA族 |