已知气体X2和气体Y2在一定条件下能化合生成气体C,并知C的化学式只有三种可能:XY、X2Y、X3Y。为确定C的化学,某同学分别取同温同压下,体积都为V1的X2和Y2两种气体充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原温后,再测出容器的容积(V2)。请填写下列结论与分析
(1)若实验结果(用V1、V2间关系来表示)是___________,则生成物C的化学式为XY,判断的依据是_____________________________________________________
(2)当生成物C的化学式为X2Y时,则实验结果是_____________,生成C的化学方程式为____________
可逆反应3A(g) 3B(?)+C(?)(正反应吸热)达到化学平衡后,
3B(?)+C(?)(正反应吸热)达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量;
②若B、C都不是气体,气体的平均相对分子质量;
③若B是气体,C不是气体,气体的平均相对分子质量;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是态,C是态。
(3)如果B为气体,C为固体,取3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L。若使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,则C的取值范围应该是。
下图为以惰性电极进行电解: 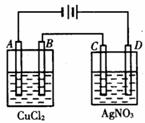
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比为____________________________。
将3.84g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气
颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到2.24L气体(标准状况),求:
(1)上述过程中,有关反应的离子方程式为;
。
(2)反应中被还原的HNO3的物质的量是 mol。生成的NO与 NO2物质的量之比为。
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要摩尔O2参加反应。
已知乳酸的结构简式为: 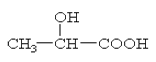
(1)则90g乳酸与足量金属钠反应产生的气体在标准状况下的体积是_____________L。
方程式为。
已知两分子乳酸可在一定条件下反应生成环状的酯,写出该反应的方程式:
。
(2)已知葡萄糖可以和醋酸在一定条件下发生酯化反应,则1摩尔葡萄糖最多可以消耗
摩尔醋酸。
(3)分子式为C6H12的某烃,其所有的碳原子都一定在同一平面上,则该烃的结构简式为
__________________。
(4)某苯的同系物分子式为C11H16,苯环上只有一个取代基,其同分异构体共有种。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为。
(2)反应开始至2min,以气体Z表示的平均反应速率为。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________(填“增大”“减小”或“相等”)。