某反应的平衡常数表达式为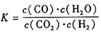 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K= 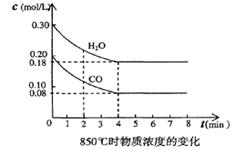
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
(10分)甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g) CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
(2)合成甲醇:①反应过程 中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
(表中数据单位:mol·L—1) ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
(10分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y、的单质是生活中常见的 金属,相关物质间的关系如下图所示。
金属,相关物质间的关系如下图所示。
回答下列问题:
(1)X的单质与A反应的化学方程式是___________________________________________。
(2)若C溶液显碱性,则试剂1是___________________________________溶液(写化学式);
若C溶液显酸性,则显酸性的原因是(用离子方程式表示)
____________________________________________________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是_______________________________________;
②写出D—E反应的离子方程式______________________________________________ __;
__;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平):
___________________________________________________________________________。
(9分)有x、Y、Z、M、R、Q六种短周期主族元素,部分信息如下表所示:
请回答下列问题:
(1)R在元素周期表中的位置是________________________________.
(2)根据表中数据推测,Y的原子半径的最小范围是_________________________.
(3)Z、M、Q的简单离子的离子半径的大小顺序为________________ (用元素符号表示)。
(4)Y与R相比,非金属性较强的是_________ (用元素符号表示),下列事实能证明这一结
论的是__________ (选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX。
c.Y与R形成的化合物中Y呈正价
(5)X、M、Z三种元素组成的化合物中含有的化学键为________;写出R的单质与上
述化合物的水溶液反应的离子方程式:
__________________________________________________________________________。
(6分)关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2 O和一种未知物质X。
O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是_____________。
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_______________________________________________。
③根据上述反应可推知________________。(填序号)
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
④在该反应中,氧化剂与还 原剂的物质的量之比为_______________。
原剂的物质的量之比为_______________。
2011年5月份以来,受到拉尼娜现象和全球大气环流异常共同作用的影响,我国南方出现持续罕见的旱情,为此专家建议尽快发展高能抗旱保水剂用来调控农田水分和作物耗水,减缓水资源短缺和干旱的危害。已知有机物I为一种保水剂,可通过烃A经下列转化生成:
提示: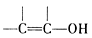 不能稳定存在。
不能稳定存在。
请回答下列问题:
(1)A和I的结构简式为:AI
(2)F中官能团的名称为:
(3)反应②和⑦的反应类型为:②⑦
(4)反应④的化学方程式为:
(5)M是一种普遍使用的抗生素类药物,它是由2个F分子在一定条件下脱去2个水分子形成的环状酯,写出该反应的化学方程式:
(6)D有两种能发生银镜反应且属链状化合物的稳定同分异构体,请写出它们的结构简式: