下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。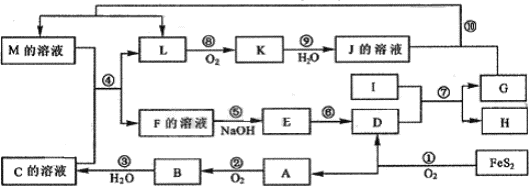
请填写下来空白:
(1)在周期表中,组成单质G的元素位于第 周期第 族。
(2)反应⑦的化学反应方程式为
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 (填写序号)
(4)反应④的离子方程式是:
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:
下列四组物质中,前者属于电解质,后者属于非电解质的是
| A.二氧化碳碳酸钠 | B.硫酸乙醇 |
| C.氧化铝硫 | D.蔗糖氢氧化钠 |
氯化铁溶液与氢氧化铁胶体的共同点是
| A.分散质颗粒直径都在l~100nm之间 | B.都能透过半透膜 |
| C.都是分散系 | D.颜色都呈红褐色 |
实验室里做钠跟水反应的实验时,用到的仪器和药品是
①试管夹②镊子③小刀④滤纸⑤研钵⑥烧杯⑦坩埚⑧石棉网⑨玻璃片⑩药匙
| A.①②③④ | B.②③④⑥⑨ | C.③④⑧⑨⑩ | D.②⑤⑦⑨⑩ |
在实验室中,对下列事故或药品的处理正确的是
| A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B.金属钠着火燃烧时,用泡沫灭火器灭火 |
| C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D.含硫酸的废液倒入水槽,用水冲入下水道 |
苹果汁是人们喜爱的饮料。由于饮料中含有Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使Fe2+转变为Fe3+离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |