一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
| A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e- |
| B.O2(g)+4H+(aq)+4e-=2H2O(1) |
| C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e- |
| D.O2(g)+2H2O(1)+4e-=4OH- |
已知:(1)H2(g)+ O2(g)═H2O(g);△H="a" kJ/mol
O2(g)═H2O(g);△H="a" kJ/mol
(2)2H2(g)+O2(g)═2H2O(g);△H="b" kJ/mol
(3)H2(g)+ O2(g)═H2O(l);△H="c" kJ/mol
O2(g)═H2O(l);△H="c" kJ/mol
(4)2H2(g)+O2(g)═2H2O(l);△H="d" kJ/mol
下列关系式中正确的是( )
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
肯定属于同族元素且性质相似的是( )
| A.原子核外电子排布式:A为1s22s2,B为1s2 |
B.结构示意图:A为 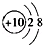 ,B为 ,B为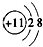 |
| C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子 |
| D.A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子 |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A.第一电离能Y可能小于X |
| B.气态氢化物的稳定性:HmY大于HnX |
| C.最高价含氧酸的酸性:X对应的酸性强于Y对应的 |
| D.X和Y形成化合物时,X显负价,Y显正价 |
下列原子中,单电子数最多的是( )
| A.16S | B.35Br | C.24Cr | D.15P |