硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率a1= ;
,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g):△H>0
2NO2(g):△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态;
b.在t2时,采取的措施可以是升高温度;
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态;
d.在t5时,容器内NO2的体积分数是整个过程中的最大值。(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g):△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g):△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应 的离子方程式是 。
的离子方程式是 。
已知:(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下: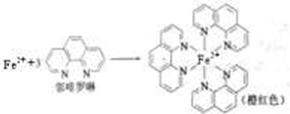
4FeCl3+2NH2OH·HCl 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,价层电子排布式 。 ②羟胺(NH2OH)中N原子的杂化方式 。
③Fe2+与邻啡罗啉形成的配合物中,配位数为 。
(2)硫酸铜晶体的化学式也可以表达为Cu(H2O)4SO4·H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等。其中元素P、As、Se第一电离能由小到大的顺序为: 。

图1 图2
(4)① 有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1 mol C60分子中π键的数目为 ,C60的晶胞结构如图2,则其配位数为_______若此晶胞的密度为ρg/cm3则两个最近C60间的距离为________cm(列式表达,已知阿伏伽德罗常数为NA)
② 如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3=Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)=。
(4)“沉淀”中含杂质离子主要有;“操作X”名称为。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为价。若放电时有1mole-转移,正极质量增加g。
CoO2+ LiC6。LiC6中Li的化合价为价。若放电时有1mole-转移,正极质量增加g。
实验题(14分):Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照: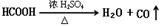 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
(1)若所制气体流向从左向右时,上述仪器连接为: A→( ) →( )→( )→( ) →( )
(2)A装置中小试管的作用(至少答两条):
①。②。
(3)证明HCOOH受热产物中有CO的现象为:。
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在处.
Ⅱ、学习小组查阅资料知:
Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。②4CuO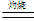 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+
= Cu+Cu2+ + H2O ;因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化。
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(5)写出Cu2O与稀硝酸反应的化学方程式:。
(6)请你评价方案②的合理性,并简述理由:方案②:,理由:。
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g) △H=" -1275.6" kJ·mol-1
② H2O(l) H2O(g) △H=" +" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 |
CO(g) +2H2(g)  CH3OH(g) CH3OH(g) |
| 方法二 |
CO2(g) +3H2(g) 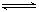 CH3OH(g) +H2O(g) CH3OH(g) +H2O(g) |
工业上可用如下方法合成甲醇: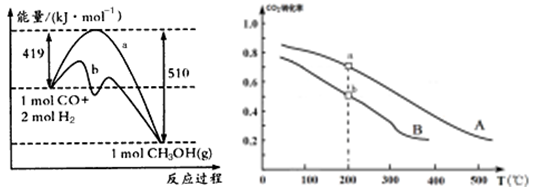
方法一方法二
①方法一:该反应的△S0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为:;a,b两点化学反应速率别用Va、Vb表示,则VaVb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式。
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: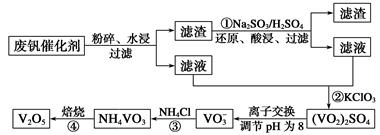
部分含钒物质在水中的溶解性如下:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式。
⑵图中所示滤液中含钒的主要成分为(写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为、。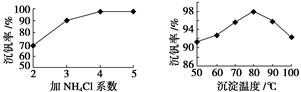
⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____=□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ 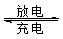 VO2++H2O+V3+,电池充电时阳极的电极反应式为。
VO2++H2O+V3+,电池充电时阳极的电极反应式为。