把18.0 mol·L -1的浓硫酸稀释成2.00 mol·L -1的稀硫酸100 ml,实验操作如下,请把正确操作步骤(用1,2,3……表示)的序号填入括号内,并填写有关的空格:
( )将配好的稀硫酸倒入试剂瓶中,贴好标签;
( )盖好容量瓶塞,反复颠倒摇匀;
( )用量筒量取 ml的18.0 mol·L -1的浓硫酸;
( )将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
( )用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
( )将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
( )改用胶头滴管逐滴加蒸馏水,至____________________________;
( )继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
(10分)下列各种不同粒子16O、1H、28Si、3H、O2、18O、29Si、O3、2H、中:
(1)有_______种不同的核素;有_________种不同的元素
(2)互为同位素的是________________,________________,________________.
A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式;
(2)B、C、D三种元素电负性由大到小的顺序是(用元素符号表示);
(3)下列有关上述元素的说法,正确的是(填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为,1 mol B2A4分子中含有molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是。
说明:O摄氏度=273K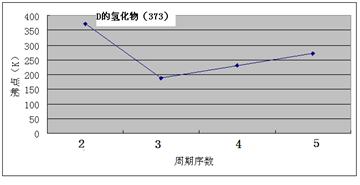
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为;
(2)冰比硫化氢熔点高的原因是,冰分子中氧原子的杂化轨道类型为;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| X |
578 |
1817 |
2745 |
11578 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
496 |
4562 |
6912 |
9543 |
元素Y第一电离能大于X的原因是;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,结构如图。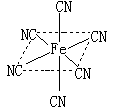
①写出铁元素基态原子价电子的轨道表示式;
②已知CN- 与 N2 结构相似,1 mol CN- 中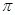 键数目为;
键数目为;
(17分)A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24。
(1)判断元素:A、B、C、D。
(2)以上这四种元素中,属于d区的是______________________(填元素符号)。
(3)C在周期表中的位置为________周期________族。
(4)写出CB2的电子式。
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有__________(填元素符号
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是__________(填“极性”或“非极性”)分子。
(17分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系(无机物略去):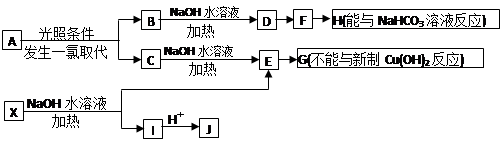
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为
(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为 、 ;
(3)E与H反应的化学方程式是
其反应类型是
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物K,以K为单体合成的高分子化合物的名称是
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。