设阿伏加德罗常数的数值为6.02×l023,下列叙述错误的是 ( )
①电解法精炼铜时转移的电子数为6.02×l023时,阳极溶解32 g铜
②7.8 g Na2S和Na202的混合物中,含有的阴离子数大于0.1×6.02×l023
③在适当条件下,2 mol S02和1 mol 02充分反应后,容器内的分子数大于2×6.02×l023
④2.9 克 2CaS04.H20含有的结晶水分子数为0.02×6.02×l023(2CaS04.H20相对分子质量为290)
⑤含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×l023
| A.①②③④⑤ | B.①③④⑤ | C.①②④⑤ | D.②③④⑤ |
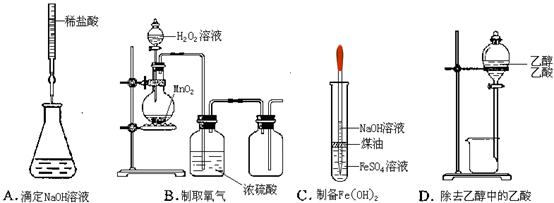
下列对有关实验的描述不正确的是
| A.在浓氨水中加入生石灰可以制取少量的NH3 |
| B.用水就可以一次性鉴别溴苯、苯、乙酸三种物质 |
C.用如图所示的装置可以测定黄铜(Cu、Zn合金)中Zn的含量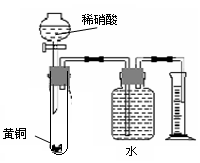 |
| D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、 Ba(OH)2、Na2CO3、HCl |
阿伏加德罗常数约为6.02×1023mol—1,下列叙述正确的是
| A.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023 |
| B.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023 |
| C.0.1 L 3 mo1·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| D.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023 |
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
据此下列说法正确的是
| A.该试剂的物质的量浓度为9.2 mol·L—1 |
| B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L |
| C.配制200 mL 4.6 mol·L—1的稀硫酸需取该硫酸50 mL |
| D.该硫酸与等体积的水混合所得溶液的质量分数小于49% |
用右图表示的一些物质或概念之间的从属或包含关系中不正确的是
| X |
Y |
Z |
|||
| 例 |
氧化物 |
化合物 |
纯净物 |
||
| A |
苯 |
芳香烃 |
有机化合物 |
||
| B |
溶液 |
分散系 |
混合物 |
||
| C |
强电解质 |
电解质 |
化合物 |
||
| D |
置换反应 |
氧化还原反应 |
离子反应 |
下列操作或仪器的选用正确的是