铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。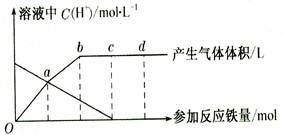
假设曲线的各段内只有一种还原产物,。
(1)0点到a点的还原产物是 。
(2)a点到b点的还原产物是__ __,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 。
.处理污水常见的化学方法有、
、等
8分).在二氧化碳、二氧化硫、二氧化氮、氟氯烃、可吸入颗粒中、目前未列入我国空气质量报告的是、全球气候变暖可能是由于含量的急剧增加,造成酸雨的主要因素是含量的增加,造成臭氧空洞的主要物质是。
完成下列方程式 ①CH3CH2CHO + Cu(OH)2
①CH3CH2CHO + Cu(OH)2 
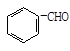
②+ H2(足量)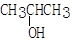

③ + O2
某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a g·cm-3。RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷bmL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀。
④将沉淀过滤、洗涤、干燥后称重,得到固体c g 。
回答下列问题:
(1)装置中长玻璃管的作用是▲。
(2)该卤代烷中所含卤素的名称是▲,判断依据是▲。
(3)如R为乙基,则RX与KOH醇溶液反应的方程式为:▲
(4)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值▲(填下列选项代码)。
| A.偏大 | B.偏小 | C.不变 | D.大小不定 |
某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为_______________________________________。