金属氧化物在下列反应中不表现为碱性氧化物性质的是
| A.Al2O3+Na2CO3==2NaAlO2+CO2 |
| B.FeO+SiO2==FeSiO3 |
| C.CaO+H2O==Ca(OH)2 |
| D.CuO+2CH3COOH==Cu(CH3COO)2+H2O |
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列说法正确的是()
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移1mol电子时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:I2>Cu2+>SO2 |
在下列给定条件的溶液中,一定能大量共存的离子组是
| A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B.能使酚酞变红的溶液中:AlO2-、K+、Cl-、Na+ |
| C.在弱酸性溶液中:Fe2+、Na+、SCN-、Cl- |
| D.常温下,在c(H+)/c(OH-)=1×10-12的溶液中:NH4+、Ca2+、Cl-、K+ |
右图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( ) 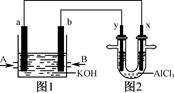
| A.图1、图2中电解质溶液的pH均增大 |
| B.图2中电解AlCl3溶液的总反应为2Cl-+2H2OCl2↑+H2↑+2OH- |
| C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO+7H2O |
| D.燃料电池内部OH-向a极移动,电解池中Cl-向x极移动 |
下列实验不能达到目的的是( )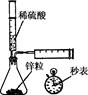
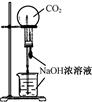
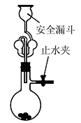
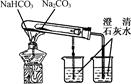
| A.测定一定时间内生,成H2的反应速率 | B.用CO2做,喷泉实验 | C.实验室制氢气 | D.比较Na2CO3与,NaHCO3的热稳定性 |
下列叙述中不正确的是( )
| A.利用核磁共振分析可以辨别甲醚(CH3OCH3)和乙醇 |
| B.利用丁达尔效应可以区分淀粉溶液与葡萄糖溶液 |
| C.在一定温度下,对于任何两种难溶电解质,Ksp大的电解质的溶解度也一定大 |
| D.ΔH>0、ΔS<0的反应在任何温度下都不能自发进行 |