对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,5υ正(O2)= 4υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| D.催化剂降低反应活化能,增大单位体积内活化分子百分数,从而增大反应速率 |
下列有关化学用语错误的是()
A.乙醇分子球棍模型: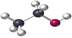 |
B.含有10个中子的氧原子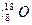 |
C.-OH的电子式: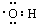 |
D.CH4Si的结构式: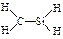 |
保护环境是每个公民的责任。下列做法:①推广使用无磷洗涤剂②城市生活垃圾分类处理③推广使用一次性筷子④推广使用清洁能源⑤过量使用化肥、农药⑥推广使用无氟冰箱。其中有利于保护环境的是()
| A.①②④⑤ | B.①②④⑥ |
| C.②③④⑥ | D.③④⑤⑥ |
为了使FeCl3溶液中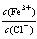 增大,可加入的物质是
增大,可加入的物质是
A.适量的HCl气体 |
B.适量的硫酸氢钠 |
| C.适量的NaOH固体 | D.适量的稀HNO3 |
天然维生素P结构如图, 关于维生素P的叙述错误的是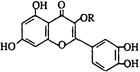
| A.可以和浓溴水反应 |
| B.可和氢气发生加成反应 |
| C.分子中有7个C=" C" 键 |
| D.1mol维生素P可以和4molNa2CO3反应 |
常温下,下列有关叙述正确的是
| A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L |
| C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③ |
| D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |