甲、乙、丙、丁四个烧杯中,依次分别放入0.1 mol的Na、Na2O、Na2O2、NaOH,然后各加水100 g,待完全溶解后,甲、乙、丙、丁四种溶液的质量分数的关系是 ( )
| A.甲<乙<丙<丁 | B.丁<甲<乙<丙 |
| C.甲=丁<乙=丙 | D.丁<甲<乙=丙 |
下列有关实验的叙述正确的是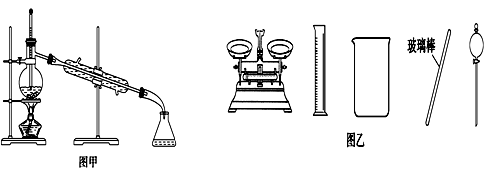
| A.可用碱式滴定管量取12.85 mL KMnO4溶液 |
| B.实验室蒸馏石油可用如图甲所示实验装置 |
| C.取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
| D.配制500 mL 0.4 mol·L-1 NaCl溶液,必要的仪器如图乙所示 |
下列各化学反应的离子方程式中,有错误的是
| A.铝与氢氧化钠反应:2Al+2OH-+2H2O=2AlO2-+3 H2↑ |
| B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
| C.碘化亚铁溶液中滴入足量溴水:2Fe2++2I-+2Br2=I2+2Fe3++4Br- |
| D.碳酸氢镁溶液中加过量澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓ |
纯碱和小苏打是厨房中两种常见用品,下列区分它们的做法正确的是
| A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打 |
| B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,火焰颜色发生明显变化的是小苏打 |
| C.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打 |
| D.用两只玻璃杯分别加入少量的两种样品,再加入等量的食醋,产生气泡速度快的是小苏打 |
下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾。试综合上述命名规律,分析回答:Na2CS3应读做
| A.硫代碳酸钠 | B.多硫碳酸钠 | C.过硫碳酸钠 | D.超硫碳酸钠 |
相同质量的钠在下列情况下产生氢气最多的是
| A.放在足量水中 |
| B.放在足量盐酸中 |
| C.放在足量CuSO4溶液中 |
| D.用刺有小孔的铝,包好放入足量水底中 |