如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.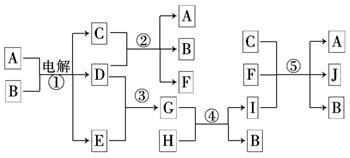
请回答下列问题:
(1)写出F的化学式:________________.
(2)人们将反应①涉及的化学工业称为 ________________.
(3)写出B与D反应的离子方程式____________________________________ ____.
____.
(4)写出反应④的离子方程式____________________________ __________________.
__________________.
(5)写出反应⑤的离子方程式_____________________________________________ _.
_.
(6)高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②___________________________________________________________________
中学化学常见物质A在一定条件下发生如下反应:A+B→E+F+H2O(未配平)
(1)若A为小苏打,F为气体。该反应的离子方程式为。
(2)若A为紫红色金属单质,气体F是由两种位于同一主族的短周期元素组成。则反应的化学方程式为_____________________。
(3)若A是磁铁矿的主要成分,B是盐酸。写出反应的化学方程式为。
(4)若A为黄氯色气体单质,F的碱性溶液吸收废气中SO2的离子方程式为。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别属于同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,又知四种元素的单质常温常压下有两种气体、两种固体。请回答下列问题:
(1)D元素在元素周期表中的位置:。
(2)B元素比D元素的非金属性强的依据是(填序号)。
a.两元素组成的化合物中D元素为正价 b.单质的熔沸点的高低
c.最高价氧化物对应的水化物的酸性强弱 d.气态氢化物的稳定性
(3)由A、B、D三种元素中的两种可分别形成甲、乙两种离子,它们均为负一价双原子核的阴离子,且甲离子含有18个电子,乙离子含有10个电子,则甲与乙反应的离子方程式为。
(4)写出C和D两元素的最高价氧化物对应的水化物在稀溶液里反应的热化学方程式:(已知此反应生成1 molH2O时放出的热量为57.3 kJ)。
(5)用A元素的单质与B元素的单质可以制成燃料电池,燃料电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则N极的电极反应式为:。
中学化学中常见的几种物质存在下图所示的转化关系。其中, A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)。
试回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式。
(2)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为。
(3)某课外小组同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是
(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因:。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,有3mol FeS2参加反应,转移mol电子。
Fe3O4+6SO2,有3mol FeS2参加反应,转移mol电子。
(2)FeCl3溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为;从腐蚀废液回收得到金属铜,还需要的试剂是。
(3)与明矾相似,Fe2(SO4)3也可用作净水剂,在使用时发现Fe2(SO4)3并不能使酸性废水中的悬浮物沉降除去,其原因是。
(4)钢铁的电化学腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框中作出修改,并用箭头标出电子流动的方向。
以下是一些元素的信息,其中有一种元素不在短周期。
| 元素A |
元素B |
元素C |
元素X |
元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 |
基态原子M层p轨道上有5个电子 |
短周期中金属性最强,与X反应能生成两种常见化合物 |
最外层电子数是内层电子数的3倍,能形成双原子阴离子 |
单质为双原子分子,结构中 键与 键与 数目比为1:2 数目比为1:2 |
根据上述信息回答下列问题:
(1)写出A元素基态原子的核外电子排布式。
(2)B、C、X的简单离子半径由大到小的顺序为(填离子符号)。
(3)H−X与H−Y两种共价键中,键的极性较强的是,键长较长的是
(X、Y用元素符号表示)。
(4)X、Y二种元素第一电离能从大到小的顺序是(填元素符号);Y的常见氢化物易液化的主要原因是。
(5)X常见氢化物的蒸气与A 的粉末在高温条件下充分反应,生成一种黑色磁性固态化合物和一种气体单质,此反应的化学方程式是。