设NA代表阿伏加德罗常数的值,下列说法中正确的是 ( )
| A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子 |
| B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1 |
| C.0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA |
D.VLCO和NO的混合气体中含有的氧原子个数为 |
下列说法中不正确的是()
| A.与煤、柴油相比较,天然气是一种比较清洁的化石燃料 |
| B.乙醇是一种可再生能源,作为燃料的优点的是完全燃烧的产物不污染环境 |
| C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量 |
| D.煤转化为水煤气再燃烧放出的热量不会增加,因此煤的气化毫无意义 |
某氯化镁溶液的密度为1.18g•cm-3,其中镁离子的质量分数为5.11%。300mL该溶液中Cl-离子的物质的量约等于:
| A.0.37mol | B.0.63mol | C.0.74mol | D.1.5mol |
标况下,两个容积相同的容器中,一个盛有NH3气体,另一个盛有N2和H2的混合气体。若两容器内的气体具有相等的电子数,则混合气体中N2和H2的物质的量之比为
| A.4:1 | B.1:2 | C.2:1 | D.1:4 |
在标准状况下,18gCO和CO2的混合气体的体积为11.2L。则此混合气体中CO和CO2的质量之比是
| A.1:1 | B.1:7 | C.1:11 | D.7:11 |
t℃时,相对分子质量为A的某物质的饱和溶液,其物质的量浓度为Bmol·L-1,密度为ρg·cm-3,则该物质在t℃时溶解度为
A.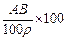 g g |
B.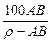 g g |
C.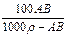 g g |
D.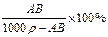 g g |