电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
| A.0.10mol/LAg+ | B.0.02mol/L Zn2+ |
| C.0.20mol/L Cu2+ | D.0.20mol/L Pb2+ |
某钠盐溶液中可能含有 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中公含 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
| A.①②④⑤ | B.③④ | C.③④⑤ | D.②③⑤ |
对实验Ⅰ~Ⅳ的实验现象预测正确的是 A 实验Ⅰ:液体分层,下层呈无色
A 实验Ⅰ:液体分层,下层呈无色
B 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C 实验Ⅲ:试管中溶液颜色不变为红色
D 实验Ⅳ:放置一段时间后,饱和CUSO4溶液中出现蓝色晶体
已知25℃时,AgⅠ饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
将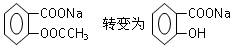 的方法是()
的方法是()
| A.与足量NaOH溶液共热后,再通入CO2 |
| B.加热溶液,再通入HCl |
| C.与足量稀硫酸共热后,加入足量Na2CO3溶液 |
| D.与足量稀硫酸共热后,加入足量的Na |
5克某一元醇A ,与乙酸发生酯化反应,得到乙酸某酯6.5克,回收未反应完的A 0.6克,则A的式量为()
| A.98 | B.116 | C.126 | D.88 |