下列说法正确的是
| A.形成离子键的阴阳离子间只存在静电吸引力 |
B.HF、HCl、HBr、 HI的热稳定性和还原性均依次减弱 HI的热稳定性和还原性均依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
下列表述不正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
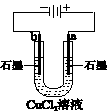
| 盐桥中的Cl-移向ZnSO4溶液 |
a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 |
粗铜的电极反应式为: Cu2++2e-=Cu |
正极反应式为: O2+4e-+2H2O=4OH- |
某含Na+的溶液中还可能含有NH4+、Fe3+、Br-、CO32-、I-、SO32-。取样,滴加足量氯水有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉溶液均无现象。为确定该溶液的组成,还需进行的实验有
| A.取样,滴加硫氰化钾溶液 |
| B.取样,加氯水和CCl4,振荡、静置 |
| C.取样,加足量盐酸加热,用湿润的品红试纸检验气体 |
| D.取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体 |
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是
| A.该反应是吸热反应 |
| B.断裂2 mol A—B键需要吸收y kJ的能量 |
| C.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
| D.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量 |
若NA表示阿伏加德罗常数,下列叙述正确的是
| A.1 mol NH3与1 mol OH-所含的质子数均为10NA |
| B.标准状况下,22.4L CHCl3中含C—H键数目为NA |
| C.1mol Fe与足量的稀HNO3反应时,转移3NA个电子 |
| D.常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
下列相关的表述不正确的是
A.HCO3-水解的离子方程式: HCO3-+H2O  CO32-+H3O+ CO32-+H3O+ |
B.电解饱和食盐水的离子方程式: 2Cl-+2H2O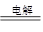 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.加入铝粉能产生氢气的溶液中,可能存在大量的: K+、Ba2+、AlO2-、Cl- |
| D.向淀粉KI溶液中滴加稀硫酸,溶液变蓝: 4I-+O2+4H+= 2H2O+2I2 |