现有五种离子化合物 A、B、C、D 和 E,组成它们的离子有:
| 阳离子 |
K+ Ag + Ba 2+ A13+ Fe3+ |
| 阴离子 |
OH - C1 - SO4 2- NO3- CO32- |
为鉴别它们,分别完成以下实验,其结果是:
a. B 和 E 的水溶液均呈碱性。
b. A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;
c. C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应。
d. E 溶于水后,与上述某阴离子反应可生成 X;
e. A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失。 请根据上述实验结果,填空:
(1)写出化合物的化学式:A ,B ,C 。
⑵ 写出D与氨水反应的化学方程式:
⑶写出实验e中“A溶液与适量 E溶液反应生成沉淀”后“再加入过量 E溶液,
沉淀量减少”的离子方程式: 。
(1)已知柠檬酸仅由C、H、O三种元素组成。其分子量不超过200,其中含氧元素58.3%。通过计算并写出柠檬酸的分子式_______________。
(2)已知某有机物的分子式为C9H10O3且具有下列性质:
①该物质能与碳酸氢钠溶液反应生成无色无味气体。
②16.6 g该物质与足量金属钠反应可生成氢气2.24 L(已折算成标准状况)。
该有机物的结构可能_______________种,请写出其中一种的结构简式_______
高分子材料PET聚酯树脂和PMMA的合成路线如下: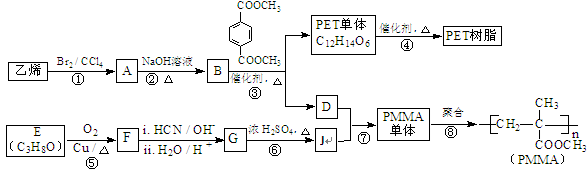
已知:
Ⅰ.RCOOR’+ R’’18OH RCO18OR’’+R’OH(R、R’、R’’代表烃基)
RCO18OR’’+R’OH(R、R’、R’’代表烃基)
Ⅱ. 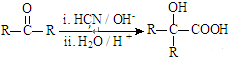 (R、R’代表烃基)
(R、R’代表烃基)
(1)①的反应类型是。
(2)②的化学方程式为。
(3)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为。
(4)G的结构简式为。
(5)下列说法正确的是(填字母序号)。
a.1 mol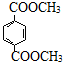 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
b.B和D互为同系物
c.⑦为酯化反应
d.D的沸点比同碳原子数的烷烃高
(6)与J具有相同官能团的J的同分异构体有多种,请写出其中无甲基的一种。
烯烃A在一定条件下可以按下面的框图进行反应.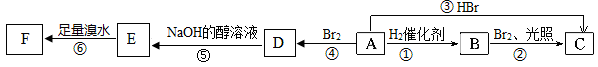
已知:D的结构简式为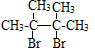 ,请完成填空:
,请完成填空:
(1)A的结构简式是:____________.
(2)框图中属于取代反应的是:________(填数字代号).
(3)C的结构简式是____________.
(4)写出由D→E的化学方程式____________________________________________
按要求填空
(1)CH2=CH—CH2—Br中含有官能团的名称:
(2)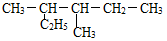 的系统命名:
的系统命名:
(3)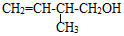 的键线式:
的键线式:
(4)下列五种有机物:能发生催化氧化为醛类物质能发生消去反应,消去反应产物有2种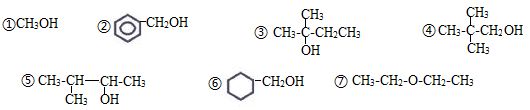
(12分,每空2分)单体液晶(有机物III)是用偶联反应合成的:
反应①
反应②
试回答以下问题:
(1)有机物Ⅰ的分子式是;有机物Ⅲ不能发生的反应为:
①取代反应、②加成反应、③醇氧化为醛(或酮)④消去反应
(2)以苯为原料生成有机物II的化学方程式为。
(3)由有机物III制备  的反应条件是。
的反应条件是。
(4)写出有机物III符合下列条件的同分异构体的结构简式(任写一个):
①苯环上有2个取代基,且环上一氯代物只有2种;②结构中含醛基,且醛基连在苯环上。
(5) 与CH3I能发生类似①的反应,该反应方程式是:。
与CH3I能发生类似①的反应,该反应方程式是:。