常见的短周期元素A、B、C、D、E的原字序数穰沃增夫。常温下,A、C可形成A2C2和A2C两种液态化合物,B原子最外层电子数是次外层电子数的2倍,D原子电子层数与最外层电予数相等,E与C同主族。
(1)上述五种元素中,非金属性最强的是 (填写元素名称)。
(2)元素D形成的简单离子的原子结构示意图为 。
(3)A的单质与C的单质在强酸性条件下构成燃料电池,其正极反应式为 。
(4)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:
(写出一种物质的化学式,下同),能抑制水电离的物质是: 。
(5)常温常压时,2.8gBC气体在3.2gC2气体中完全燃烧,生成BC2气体时放出28.3kJ的热量,则表示BC燃烧的热化学方程式为 。
化学反应原理对于工业生产和科研有重要意义
I、下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973 K |
1173 K |
||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) |
K3 |
? |
? |
请回答:
(1)反应①是(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 _____(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________; t8时__________________。
②若t4时降压, t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
II、(5)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为。
(6)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液。
如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为mol。
已知有机物A分子由C、H、O三种元素组成,其蒸汽密度是相同条件下氢气密度的60倍,0.1molA在足量的氧气中充分燃烧后生成0.8molCO和7.2gH2O,A可以发生银镜反应,其苯环上的一氯代物有3种。
现有如下转化关系: 其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
(1)A中含氧官能团的名称是,A的结构简式为。
(2)C可能具有的化学性质有(填序号)。
①能与H2发生加成反应
②能在碱性溶液中发生水解反应
③能与甲酸发生酯化反应
④能与Ag(NH3)2OH溶液发生银镜反应
⑤能与NaOH溶液反应
A.①②③ B.①③⑤ C.①②③⑤ D.②③④⑤
(3)① 写出C→D的化学反应方程式_______;反应类型为_____________________。
② 催化剂条件下,D生成高聚物的化学方程式;
③ G与足量NaHCO3溶液反应的化学方程式。
(4)C的同分异构体有多种,其中符合下列要求的有机物有两种:
①属于酯类化合物②遇三氯化铁溶液显紫色
③与新制氢氧化铜悬浊液共热可生成红色沉淀④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式。
(5)聚乳酸( )可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
)可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
合成路线示例:
下表为元素周期表的一部分:
| 族 周期 |
||||||||
| 1 |
① |
|||||||
| 2 |
② |
|||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
(4)写出固体A与液体X反应的离子方程式。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是。
A.温度不变 B.气体总压强不变 C.混合气体的密度不变 D.混合气体的平均分子量不变
药物菲那西汀的一种合成路线如下:
(1)菲那西汀的分子式;
(2)①~⑥反应过程中在苯环上发生取代反应的是;
(3)反应②中生成的无机物的化学式为;
(4)写出⑤反应的化学方程式;
(5)菲那西汀水解的化学方程式是_____________________;
(6)菲那西汀的同分异构体中,符合下列条件的共有种。
①含苯环且只有对位两个取代基②苯环上含有氨基③能水解,水解产物能发生银镜反应。
(7)菲那西汀的同分异构体中,含苯环且只有对位两个取代基,两个取代基含有相同碳原子数,且含有α-氨基酸结构,写出这种同分异构体缩聚后高分子产物的结构简式。
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的等电子体是(写一种)。LiBH4中不存在的作用力有___(填标号)。
A.离子键 B.共价键C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/KJ·mol-1 |
I2/KJ·mol-1 |
I3/KJ·mol-1 |
I4/KJ·mol-1 |
I5/KJ·mol-1 |
| 738 |
1451 |
7733 |
10540 |
13630 |
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____种。
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HF。
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X—定不是______(填标号)。
A.H2OB.CH4C.HF D.CO(NH2)2
(5)纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为。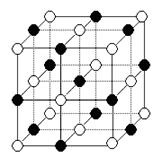
A.87.5% B.92.9% C.96.3% D.100%