50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题: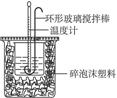
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:______________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。
A、B、C、D、E、F、X存在如图所示转换关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。X可能是强酸,也可能是强碱。
(1)A的化学式是___________________。
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为_____________________________。
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物。
①过量的B跟Cl2反应的化学方程式为______________________。
②工业生产中B→D的化学方程式为_______________________。
最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是________。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是______(填序号)。
A.CO32- HSO3- B. HCO3- HSO3- C. SO32- HCO3- D. H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
①根据上表判断NaHSO3溶液显_______性,试解释原因__________________________;
②在NaHSO3溶液中离子浓度关系不正确的是_______(填序号)。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
C.c(H2SO3)+ c(H+)=c(SO32-)+c(OH-)
D.c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,电解示意图如下: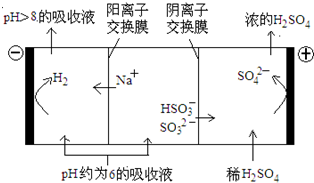
①写出阳极上发生的电极反应式____________;
②当电极上有1mol电子转移时阴极产物的质量为__________。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: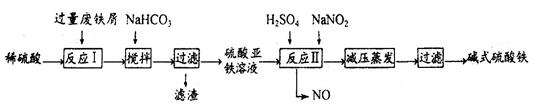
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
(1)已知反应及几种物质中化学键断裂时的能量变化如下所示:
H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g)△H=-115.6kJ/mol
①H2与O2反应生成气态水的热化学方程式为_________________________________;
②断开1mol H—O键所需能量约为_________________________kJ。
(2)已知某反应的平衡常数表达式为:K=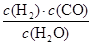 ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。
(3)已知反应N2(g)+3H2(g) 2NH3(g)△H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g)△H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
A.缩小体积增大压强 B.升高温度
C.加催化剂 D.使氨气液化移走
(4)在一定体积的密闭容器中进行如下化学反应:A(g)+3B(g) 2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
| T/K |
300 |
400 |
500 |
…… |
| K/(mol·L-1)2 |
4×106 |
8×107 |
1.2×109 |
…… |
①断送该反应的△H_________0(填“>”或“<”);
②在一定条件下,能判断该反应一定达化学平衡状态的是______(填序号)。
A.3 υ(B)正=2υ(C)逆 B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是常见的非金属元素,主要以钠盐的形式存在于海水中。
(1)Y在元素周期表中的位置是________;X氢化物的电子式为_________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈_______(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是________。
(3)Y-Ag2O电池是应用广泛的鱼雷电池,其原理如下图所示。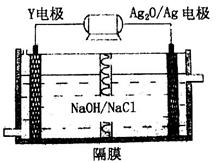
该电池的负极反应式是________。
(4)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是_________
(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性