在密闭容器中进行如下反应:X2(g)+Y2(g)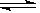 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A.Z为0.3 mol·L-1 | B.Y2为0.35 mol·L-1 |
| C.X2为0.2 mol·L-1 | D.Z为0.4 mol·L-1 |
生活中涉及的许多问题与化学有关,下列说法正确的是
| A.“白色污染”是指塑料包装袋等塑料垃圾 |
| B.碘盐中的碘不是碘单质 |
| C.“绿色食品”是指绿色的食品 |
| D.工业酒精中因含较多甲醇,故严禁饮用 |
下列物质能与乙酸反应的是
| A.镁 | B.氧化铜 | C.苛性钠 | D.小苏打 |
氢氧燃料电池的电解质溶液常见有硫酸和氢氧化钾两种,下列有关叙述不正确的是
| A.此电池能发出蓝色的火焰 |
| B.氧气为正极,氢气为负极 |
| C.工作时电解液一定与H2反应 |
| D.负极:2H2+4OH-—4e-===4H2O |
某原电池工作时总的反应为Zn+Cu2+===Zn2++Cu,该原电池的组成可能是
| A.Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 |
| B.Cu为正极,Zn为负极,稀H2SO4作电解质溶液 |
| C.Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 |
| D.Fe为正极,Zn为负极,CuCl2溶液作电解质溶液 |
铝片与盐酸的反应属于
| A.吸热反应 | B.放热反应 | C.氧化还原反应 | D.非氧化还原反应 |