如右图所示,A、B、C三个装置中的三个烧杯分别盛有足量的CuCl2溶液。 
A(左Zn右Cu) B(左C右Pt) C(左Zn右Cu)
(1)、A、B、C三个装置中属于原电池的是_____ (填标号,下同),属于电解池的是___ _________。
(2)、A池中Zn是_______极,发生_______反应(填“氧化”或“还原”,下同),电极反应式为_________; Cu是_____极, 发生_____反应, 电极反应式为 ,A中总反应的化学方程式为 。
(3)、B池中C是_____极,发生_____反应,电极反应为 ;Pt是_____极,发生______反应,电极反应为 。B池中总反应的化学方程式为 ________________。
(4) C池中Zn是_____极,发生______反应,电极反应为_______________;Cu是 极, 发生 反应, 电极反应为 反应过程中,溶液浓度________(填“变大”“变小”或“不变”)。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: 据此判断:
据此判断:
(1)固体B所含物质的化学式为;(2)固体E所含物质的化学式为;
(3)反应①的离子方程式为。
胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸或酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是(填化学式);乙中含有的主要化学成份是(填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:。
甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是。
写出“乙 丙”转化的离子方程式:。
丙”转化的离子方程式:。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是:。
写出“甲 乙”转化的离子方程式:。.
乙”转化的离子方程式:。.
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中周期族
请写出C的电子式。
(2)A在B中燃烧的现象是。
(3)D+E→B的反应中,n(被氧化的物质):n(被还原的物质)=。
(4)G+J→M的离子方程式是。
写出C+F→G的离子方程式是。
(5)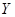 受热分解的化学方程式是。
受热分解的化学方程式是。
有关元素X、Y、Z、W的信息如下:
| 元素 |
有关信息 |
| X |
原子半径为0.074 nm,其氢化物的结构模型可表示为: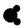 常温下是液体 常温下是液体 |
| Y |
原子半径为0.102 nm,其原子核外电子排布为: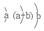 |
| Z |
人体中必需微量元素中含量最多,体内缺失会引起贫血 |
| W |
所在主族序数与所在周期序数之差为4 |
请回答下列问题:
(1)Z在元素周期表中的位置是。
(2)Y与W相比,非金属性较强的是(填元素符号),下列事实能证明这一结论的是(填字母)。
a. W元素氢化物的稳定性大于Y元素氢化物的稳定性
b. W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c. W元素的单质能与Y元素的氢化物反应,置换出Y单质
d. W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子ZX42-,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
ZX42-具有强氧化性,能杀菌消毒,还原产物是Z3+,含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明)。