若实验室制取的二氧化碳中含有少量的氯化氢气体,除去氯化氢最适宜的物质是( )
| A.氨水 | B.碳酸钠饱和溶液 |
| C.浓硫酸 | D.碳酸氢钠饱和溶液 |
下列说法正确的是
| A.除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 |
| B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 |
| C.自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 |
| D.室温下,浓度均为0.1mol·L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
下列说法不正确的是
| A.科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用SMT技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 |
| B.利用外接直流电源保护铁质建筑物,属于外加电流的阴极保护法 |
| C.今年,来自德国、加拿大和我国复旦、清华大学的研究人员通过紧密合作,成功制备出了含+9铱元素的离子(IrOn+)。在这种离子中,n=8 |
| D.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
X、Y、Z、W四种短周期元素,原子序数依次增大。且Y、Z、W为同周期元素,X、Z同主族,X、Z可形成共价化合物ZX3 和ZX2 ,Y的原子结构示意图如下图,据此填空:
(1)Y的元素名称为。
(2)X、Y、Z三种元素的原子,半径由小到大的顺序为(用元素符号表示)。
(3)Y和W最高价氧化物的水化物酸性由强到弱的顺序为(用化学式表示)。
(4)已知Na和单质Z可以形成离子化合物,写出该物质的电子式:。
将充有n mL NO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2。m>n,则充分反应后,试管中气体在同温同压下的体积为
A.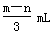 |
B.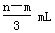 |
C.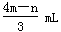 |
D.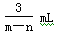 |
往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是
| A.该实验表明FeCl3有还原性 | B.白色沉淀为BaSO3 |
| C.该实验表明SO2有漂白性 | D.反应后溶液酸性增强 |