在电解食盐水之前,需要提纯食盐水。(1)为除去粗盐中的Ca2+.Mg2+.SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
| A.①④②⑤③ | B.④①②⑤③ |
| C.②⑤④①③ | D.⑤②④③① |
下列说法正确的是
| A.固体氯化钠不导电,所以氯化钠是非电解质 |
| B.铜丝能导电,所以铜是电解质 |
| C.氯化氢是电解质,其水溶液能导电 |
| D.CO2的水溶液能导电,所以CO2是电解质 |
检验氯化氢气体中是否混有Cl2,可采用的方法是()
| A.用干燥的蓝色石蕊试纸 | B.用干燥有色布条 |
| C.将气体通入AgNO3溶液 | D.用湿润的淀粉碘化钾试纸 |
据科学家预测,月球的土壤中吸附着数百万吨的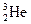 ,每百吨
,每百吨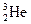 核聚变所释放出的能量相当于目前人类一年消耗
核聚变所释放出的能量相当于目前人类一年消耗 的能量。在地球上,氦元素主要以
的能量。在地球上,氦元素主要以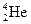 的形式存在。下列说法正确的是:()
的形式存在。下列说法正确的是:()
A.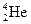 原子核内含有4个质子 原子核内含有4个质子 |
B.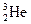 原子核内含有3个中子 原子核内含有3个中子 |
C.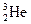 和 和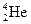 互为同位素 互为同位素 |
D.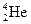 的最外层电子数为2,所以 的最外层电子数为2,所以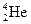 具有较强的金属性 具有较强的金属性 |
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
| A.硫酸、硫酸铜、纯碱 | B.水、空气、纯碱 |
| C.醋酸、空气、生石灰 | D.硝酸、食盐水、烧碱 |
下实验操 作,不正确的是______
作,不正确的是______ _________
_________ _
_ ____。
____。
| A.取用固体大颗粒药品一般用手拿 |
| B.用纸槽往试管里装粉末状药品时,试管应先横放再直立 |
| C.向酒精灯内添加酒精时,不得超过酒精灯容积的三分之一 |
D.试管、烧 杯、量筒、集气瓶都不能用于在酒精灯火焰直接加热。 杯、量筒、集气瓶都不能用于在酒精灯火焰直接加热。 |
E.  用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化