醇在催化作用下氧化成醛的反应是绿色化学的研究内容之一。某科研小组研究了钯催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K2CO3、363K、甲苯(溶剂)。实验结果如下: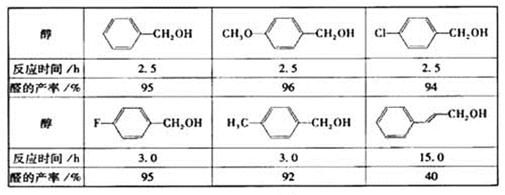
分析表中数据,得到钯催化剂催化效果的主要结论是
(写出2条)。
 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红 色(或砖红色)的
色(或砖红色)的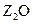 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。 (1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
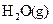 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。 (2)Y的基态原子核外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
(2)Y的基态原子核外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。 (3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是 ______________________________________________________________________。
______________________________________________________________________。
(4)
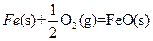
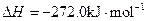

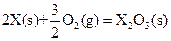
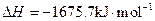
 X的单质和FeO反应的热化学方程式是_________________________________________。
X的单质和FeO反应的热化学方程式是_________________________________________。
(12分) 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应: Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g) ①该反应的平衡常数表达式为:K=
①该反应的平衡常数表达式为:K= ②该温度下,在2L盛有
②该温度下,在2L盛有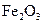 粉末的密闭容器中通入CO气体,10min后,生成了单
粉末的密闭容器中通入CO气体,10min后,生成了单 质铁11.2g。则10min内CO的平均反应速率为
质铁11.2g。则10min内CO的平均反应速率为 (2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态: ①②
①② (3)写出氢氧化铝在水中发生碱式电离的电离方程式:
(3)写出氢氧化铝在水中发生碱式电离的电离方程式: 欲使上述体系中
欲使上述体系中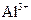 浓度增加,可加入的物质是。
浓度增加,可加入的物质是。
水的电离平衡曲线如下图所示。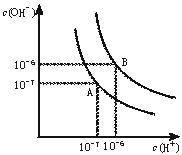
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度 下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为
下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为,C的元素符号为;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式为。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的电子排布式为。
(12分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题: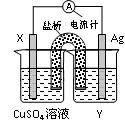
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,
发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。