下列五组物质,每组中有一种物质从某种角度分析与其它四种不同,请找出该物质,并说明理由。
⑴Fe、S、C、P 不同物质 理由 ;
⑵H2、O2、N2、S 不同物质 理由 ;
⑶Fe2O3、NaCl、CuO、H2O 不同物质 理由 ;
⑷AgCl、BaSO4、KNO3、CaCO3不同物质 理由 ;
⑸CuSO4、FeCl3、KMnO4、K2CO3不同物质 理由 。
(1)9.2 g氮的氧化物NOx中含N原子数为0.2 mol,则NOx的摩尔质量为_________,x数值为_________,同质量的NOx在标准状况下的体积是_________。
(2)在某温度时,一定量的元素A的气态氢化物AH3,在一定体积的密闭容器中完全分解成两种气体单质,此时压强增加了75%,则A单质的化学式为_________。
25 ℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,则原CO和H2的混合气体中,V(CO)=_____________,V(H2)=_________________________。
(2)若剩余气体的体积是a L,则原CO和H2的混合气体中,V(CO)∶V(H2)=________。
(3)若剩余气体的体积是a L,则a的取值范围是__________________________________。
一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(l)+3O2(g)====XO2(g)+2YO2(g)。冷却后,在标准状况下测得生成物的气态体积是672 mL,密度是2.56 g·L-1,则:
(1)反应前O2的体积是___________________________________。
(2)化合物XY2的摩尔质量是______________________________。
(1)由氦气和氧气组成的人造空气2.4 g在标准状况下测得其体积为5.6 L,则此人造空气的摩尔质量为_______________。
(2)按体积比为1∶2∶3组成的N2、O2、CO2混合气体100 g,在标准状况下的体积为________。
在KCl、ZnCl2、ZnSO4三种盐配成的混合溶液中,已知K+为0.1 mol,Zn2+为0.25 mol,Cl‑为0.2 mol,则SO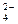 为______________mol。
为______________mol。
碱式碳酸铜受热会完全分解,Cu2(OH)2CO3 H2O+2CuO+CO2↑,则120 ℃时分解产生的混合气体的平均相对分子质量是___________。
H2O+2CuO+CO2↑,则120 ℃时分解产生的混合气体的平均相对分子质量是___________。
成年男子的肺活量为3 500~4 000 mL,成年女子的肺活量约为2 500~3 500 mL,肺活量较大的男子与肺活量较小的女子所容纳气体的物质的量之比为(在同温同压下)_________。