有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl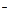 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)为( )mol·L-1( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)为( )mol·L-1( )
| A.(y-2x)/a | B.(y-x)/a |
| C.(2y-2x)/a | D.(2y-4x)/a |
同温同压下,3体积A2气体跟1体积B2气体完全反应生成2体积C气体,则它的化学式是( )
| A.A2B | B.AB2 | C.BA3 | D.B3A |
设NA表示阿伏加德罗常数的值,下列说法中正确的是()
| A.1 mol NH4+所含质子数为10NA |
| B.10克氖气所含原子数约为6.02×1023 |
| C.标准状况下,22.4 L H2O所含的分子数为NA |
| D.常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
质量为1g的H2O中含m个氢原子,则阿伏加德罗常数的数值为( )
| A.m/9 | B.9m | C.2m | D.m |
下列说法不正确的是()
| A.溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小 |
| B.可以用丁达尔现象区别胶体与溶液 |
| C.胶体和浊液不能透过滤纸而溶液可以 |
| D.向氢氧化铁胶体中加入硫酸钠溶液能够出现沉淀 |
在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为 ( )
| A.1:2:3 | B.3:2:1 | C.1:1:1 | D.6:3:2 |