.在20℃时一刚性容器内部有一不漏气且可左右滑动的活塞将容器分隔成左、右室两室。左室充入N2,右室充入H 2和O 2的混合气体,此时活塞正好停留离左端1/4处(如右图a)然后用电火花引燃右室气体,反应完毕恢复至原来温度,活塞恰好停留在容器中间(如右图b),水蒸气的体积可忽略,则反应前充入右室的混合气体中H 2和O 2的体积比为?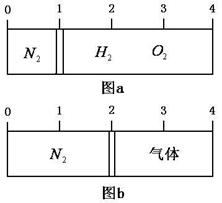
乙醇分子中的化学键如右图所示,在不同反应中断键不同:和金属钠反应键断裂;化学方程式是,在Cu催化下和O2反应键断裂,化学方程式是,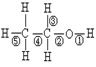
有几种元素的微粒的最外电子层结构如图所示,其中:
(1)若该微粒呈电中性且一般不和其他元素的原子反应,这种微 粒符号是。
(2)若该微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊, 这种微粒的电子式是_______。
(3)若该微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是______。
已知1,3-丁二烯(CH2=CH-CH=CH2)在一定条件下可以与同物质的量的溴发生如下1,4-加成反应: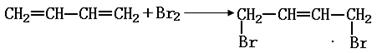
现由氯苯制备1,4-环己二醇,有以下7步反应(其中无机产物都已略去),其中有一步属于取代反应,两步属于消去反应,四步属于加成反应。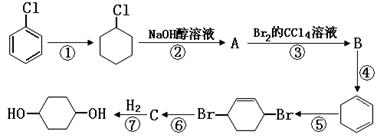
试回答:
(1)属于取代反应的是,属于消去反应的是。(填写序号)
(2)化合物的结构简式:B;C。
(3)反应④和反应⑥的反应条件:④;⑥。
(4)写出反应②的化学方程式:。
(1)二甲苯苯环上的一溴代物有六种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别为:
| 一溴代二甲苯 |
234℃ |
206℃ |
213.8℃ |
204℃ |
214.5℃ |
205 |
| 对应的二甲苯 |
-13℃ |
-54℃ |
-27℃ |
-54℃ |
-27℃ |
-54℃ |
熔点为234℃分子的结构简式为____________
(2)完全燃烧下列烃①丙烷(C3H8)、②丁烯(C4H8)、③乙烯(C2H4)、④己烷(C6H14),等物质的量的上述四种烃,耗氧量最小的为(填写序号);等质量时,则耗氧量最大的为(填写序号)。
(3)0.2 mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
① 若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
② 若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是________________。
(4)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗O2的体积是同状况下该烃蒸气体积的8.5倍,由此分析回答:
①若该烃为链状二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,则该烃的结构简式为______________________________________
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为______________(填任一种)。
吗啡和海洛因都是严格查禁的毒品。吗啡分子中C、H、N、O的质量分数分别为71.58%、6.67%、4.91%和16.84%,已知其相对分子质量不超过300。
求:(1)一个吗啡分子中含_________个氮原子
(2)吗啡的相对分子质量___________
(3)吗啡的化学式_________________